(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
 =
=②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率

 ,该反应的
,该反应的 H
H③向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g)△H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g)△H=+480 kJ/mol,则a=
(2)某实验小组在实验室模拟反应C(s) +H2O (g)⇌CO (g) +H2(g)能够说明该反应达到平衡状态的是
a. v逆(H2O)=v正(CO)b.容器中物质的总质量不发生变化
c. n (H2O):n (H2)=1:1且不再改变d.恒容容器中混合气体密度不变
(3)一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O发生反应①,6min时生成0.7 gH2则6 min内以CO表示的平均反应速率为
(4)燃料气中CO需氧化为CO2与氢气进行分离,使用CuO/CeO2做催化剂,并向其中加入不同的酸(HIO3或H3PO4)后,CO的转化率随温度的变化如图所示。

①加入H3PO4
②CeO2可由草酸铈[Ce2(C2O4)3]在空气中灼烧制备,同时只产生一种气体,写出该反应的化学方程式
③恒温恒压下,在温度为120°C,催化剂为CuO/CeO2・HIO3条件下反应,若起始时燃料气流速为1800mL∙min-1,其中CO的体积分数为0.68%,则反应0.5h后剩余气体中CO的体积为
(5)有人将合成氨反应设计成原电池,装置如图所示。
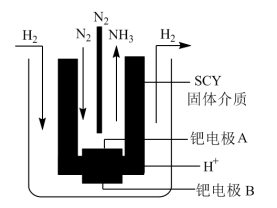
①正极反应式为
②已知该原电池的标准电动势
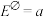 ,25°C时反应的平衡常数K与
,25°C时反应的平衡常数K与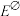 之间的关系为
之间的关系为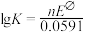 (n为原电池反应转移的电子数),则合成氨反应(N2+3H2
(n为原电池反应转移的电子数),则合成氨反应(N2+3H2 2NH3)的平衡常数K为
2NH3)的平衡常数K为(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),酸性K2Cr2O7溶液可将这种碳纳米颗粒氧化为无毒气体而除去,该反应的还原产物为Cr3+,请写出相应的离子方程式:
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)
 CH3OH (g) ΔH1=-116 kJ·mol-1
CH3OH (g) ΔH1=-116 kJ·mol-1 ①下列措施中可增大H2的平衡转化率的是
A.升高反应温度 B.增大体系压强
C.使用高效催化剂 D.及时将CH3OH与反应混合物分离
②向2L的恒容密闭容器中充入1mol CO和2mol H2,进行上述反应,5min后达到平衡状态,此时体系的压强变为原来的 。则此段时间v(H2)=
。则此段时间v(H2)=
③已知:
2CO (g) + O2 (g)  2CO2 (g) ΔH2=-566 kJ·mol-1
2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2 (g)  2H2O (g) ΔH3=-484 kJ·mol-1
2H2O (g) ΔH3=-484 kJ·mol-1
则气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
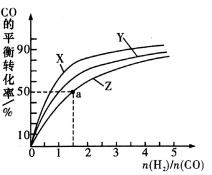
请回答:
ⅰ.在上述三种温度中,曲线Z对应的温度是
ⅱ.利用图中a点对应的数据,计算出曲线Z在对应温度下
CO (g) + 2H2 (g) CH3OH (g)的平衡常数K的值为 =
CH3OH (g)的平衡常数K的值为 =
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为



