名校
解题方法
1 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
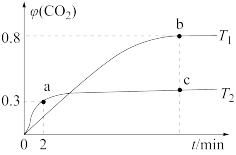
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
164次组卷
|
6卷引用:湖南省衡阳市26中2017-2018学年高二上学期期中考试化学试题
名校
解题方法
2 . (1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________ (用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________ ;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________ (填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________ kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________ (填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K= 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________ (填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________ (填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________ (填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
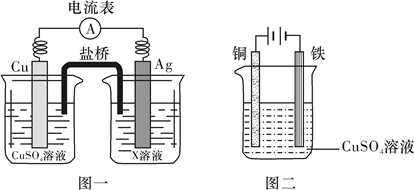
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________ (填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________ 。
②常温下,0.050 0 mol/L硫酸溶液的pH=
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=
 。
。①反应达到平衡后,向容器中通入CO,化学平衡向
②若降低温度,平衡常数K
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。

①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是
您最近一年使用:0次
名校
3 . Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______ (填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________ 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________________ 。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
(4) 容器I中的反应达到平衡时所需的时间_______ (填“大于”“小于”或等于)容器II中的。
(5) a=_____
(6) 下列说法中能说明该反应达到平衡状态的是__________ 。(填字母)
A. 容器中压强不变 B. 混合气体中c(CH3OCH3) 不变
C. 混合气体的密度不变 D. 单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是__________ (填字母)。
A. n﹥2m B. m﹥2 n C. 2m﹥n D. m﹥3n
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)
 CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
 CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) 容器I中的反应达到平衡时所需的时间
(5) a=
(6) 下列说法中能说明该反应达到平衡状态的是
A. 容器中压强不变 B. 混合气体中c(CH3OCH3) 不变
C. 混合气体的密度不变 D. 单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)
 CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1反应②:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1 则下列m与n的关系中,正确的是
A. n﹥2m B. m﹥2 n C. 2m﹥n D. m﹥3n
您最近一年使用:0次
2016-12-09更新
|
647次组卷
|
2卷引用:2015-2016学年湖南省长沙市望城一中高二下期末理科化学试卷
4 . 十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为___________ 。
(2)利用现代传感技术探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。

①B、E两点对应的正反应速率大小为vB_____ vE(填“>” 或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为_____ (填字母序号)。
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为_________ 。

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:
(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为__________ kPa∙min-1。
②T1℃时,反应的平衡常数Kp=______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为
(2)利用现代传感技术探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
①B、E两点对应的正反应速率大小为vB
②E、F、H三点对应气体的平均相对分子质量最大的点为
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g)
 HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=
 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为②T1℃时,反应的平衡常数Kp=
您最近一年使用:0次
解题方法
5 . 氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。回答下列问题:
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有______ (填字母标号)。
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为______ 、______ ,消耗等量的N2H4时释放能量较多的是_______ (填“原理(I)”或“原理(II)”)。
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有_______ (填字母标号)。
a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g) ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
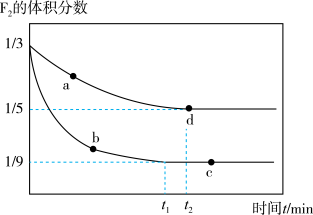
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为_________ 。
②反应进行到d点时,反应速率v(F2)=______ mol/(L·min)。
③c点处,F2的平衡转化率α=_______ %,d点处,平衡常数Kc=________ 。
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H_____ 0(填“>”“ <”或“=”),F2的平衡转化率α_______ (填“增大”“减小”或“不变”)。
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为
②反应进行到d点时,反应速率v(F2)=
③c点处,F2的平衡转化率α=
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H
您最近一年使用:0次
6 . (1)已知: 25℃、101 kPa时,
I.H2(g) + O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H =___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g) CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___ 41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___ (填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__ ( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__ (填 “a”或“b”);②有关溶液变化的描述正确的是______ ;

A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
I.H2(g) +
 O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/molII.H2(g) +
 O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol试回答下列问题:
①能表示氢气燃烧热的热化学方程式为
②H2O(g) = H2O(l) △H =
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)
 CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:①放出的热量
②该反应的平衡常数表达式K =
③其他条件不变时,升高温度,c(H2)将
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是

A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为
您最近一年使用:0次
7 . 氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2 合成甲烷的热化学方程式为:CO(g) +3H2(g)==CH4(g) +H2O(1) △H
则△H=________ ;该反应能自发进行的原因是_____________________________________ 。
(2)工业上一般采用下列两种反应合成甲醇:
反应I :CO(g) +2H2( g) CH3OH(g)
CH3OH(g)
反应II :CO2(g) +3H2(g) CH3OH( g) + H2O( g)
CH3OH( g) + H2O( g)
①一定温度下,在体积可变的恒压密闭容器中加入4mol H2 和 一定量的CO 发生反应I,开始时容器体积为2L,CO 和CH3OH( g)的浓度随时间变化如图1。10min 达到平衡,则反应I的化学平衡常数为______________ (结果保留一位小数)。

②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,下列描述能说明反应II 已经达到平衡状态的是________________ (填序号)。
A.容器内CO2 的体积分数不再变化 B.当CO2 和H2 转化率的比值不再变化
C.当水分子中断裂2NA个O-H 键,同时氢分子中断裂3NA个H-H 键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH 作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________ ;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______ g。

(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g) + CH3OH(g) HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________ 。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2 合成甲烷的热化学方程式为:CO(g) +3H2(g)==CH4(g) +H2O(1) △H
则△H=
(2)工业上一般采用下列两种反应合成甲醇:
反应I :CO(g) +2H2( g)
 CH3OH(g)
CH3OH(g)反应II :CO2(g) +3H2(g)
 CH3OH( g) + H2O( g)
CH3OH( g) + H2O( g)①一定温度下,在体积可变的恒压密闭容器中加入4mol H2 和 一定量的CO 发生反应I,开始时容器体积为2L,CO 和CH3OH( g)的浓度随时间变化如图1。10min 达到平衡,则反应I的化学平衡常数为

②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,下列描述能说明反应II 已经达到平衡状态的是
A.容器内CO2 的体积分数不再变化 B.当CO2 和H2 转化率的比值不再变化
C.当水分子中断裂2NA个O-H 键,同时氢分子中断裂3NA个H-H 键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
(3)用KOH 作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为

(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g) + CH3OH(g)
 HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
HCOOCH3(g) △H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
8 . 目前处理烟气中的SO2有三种方法:液吸法、还原法、电化学法。
I.液吸法
25℃,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5
第1步:用过量浓氨水吸收SO2,并在空气中氧化。
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
(1)25℃,(NH4)2SO3溶液呈___________ (填“酸性”、“碱性”、“中性”)
(2)通过计算第2步反应的K判断第2步反应___________ (填“能”或“不能”)进行完全。(一般认为K>105时反应就进行完全了。)
Ⅱ.还原法
已知:①2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.0kJ·mol-1
S(l)+2CO2(g) △H1=-37.0kJ·mol-1
②2H2(g)+SO2(g) S(1)+2H2O(g) △H2=+45.0kJ·mol-1
S(1)+2H2O(g) △H2=+45.0kJ·mol-1
③2CO(g)+O2(g)==2CO2(g)△H3=-566.0 kJ·mol-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mol-1
(1)写出液态硫(S)燃烧的热化学方程式_________________________________ 。
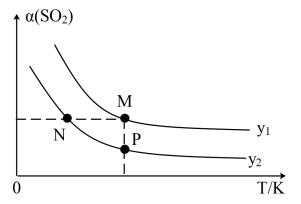
(2)一定压强下,反应①SO2的平衡转化率[α(SO2)]与投料比的比值 温度(T)的关系如图所示。
温度(T)的关系如图所示。
则CO的平衡转化率:N___________ M(填“>”、“<”、“=”,下同);逆反应速率:N___________ P。
Ⅲ.电化学法
(1)原电池法:写出SO2、O2和稀H2SO4所构成的原电池的负极反应式___________ 。
(2)电解法:先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如下图所示。
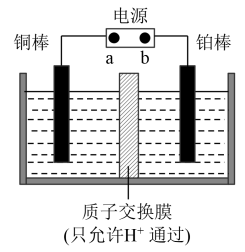
①b为电源的___________ (填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是______________________ 。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫___________ kg。
I.液吸法
25℃,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5
第1步:用过量浓氨水吸收SO2,并在空气中氧化。
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。(1)25℃,(NH4)2SO3溶液呈
(2)通过计算第2步反应的K判断第2步反应
Ⅱ.还原法
已知:①2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1=-37.0kJ·mol-1
S(l)+2CO2(g) △H1=-37.0kJ·mol-1②2H2(g)+SO2(g)
 S(1)+2H2O(g) △H2=+45.0kJ·mol-1
S(1)+2H2O(g) △H2=+45.0kJ·mol-1③2CO(g)+O2(g)==2CO2(g)△H3=-566.0 kJ·mol-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mol-1
(1)写出液态硫(S)燃烧的热化学方程式
(2)一定压强下,反应①SO2的平衡转化率[α(SO2)]与投料比的比值
 温度(T)的关系如图所示。
温度(T)的关系如图所示。则CO的平衡转化率:N

Ⅲ.电化学法
(1)原电池法:写出SO2、O2和稀H2SO4所构成的原电池的负极反应式
(2)电解法:先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如下图所示。

①b为电源的
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫
您最近一年使用:0次
解题方法
9 . 砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________ 。

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________ 0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)=____________ 。
③下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________ 。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________ ,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________ (保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H
②0~10min内,I的反应速率v(Iˉ)=
③下列情况表明上述可逆反应达到平衡状态的是
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当
您最近一年使用:0次
2018-04-10更新
|
305次组卷
|
2卷引用:湖南省G10教育联盟2018届高三4月联考理综化学试题2
名校
解题方法
10 . 2018年9月26日,第五届硒博会在恩施州文化中心大剧院开幕。第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2 (g)+O2(g 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1
反应H2(g)+ Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=______ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是_______ (填字母代号)。
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:________________________________________________ 。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:

则制备H2Se的最佳温度和压强为________ 。
(3)已知常温下H2Se的电离平衡常数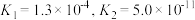 ,则NaHSe溶液呈
,则NaHSe溶液呈_______ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9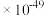 ,CuS的
,CuS的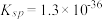 ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2 (g)+O2(g
 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1反应H2(g)+ Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:

则制备H2Se的最佳温度和压强为
(3)已知常温下H2Se的电离平衡常数
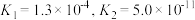 ,则NaHSe溶液呈
,则NaHSe溶液呈(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9
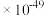 ,CuS的
,CuS的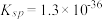 ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
2019-04-17更新
|
621次组卷
|
2卷引用:【全国百强校】湖南省长沙市雅礼中学2019届高三下学期第8次月考试理科综合化学试题



