名校
解题方法
1 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
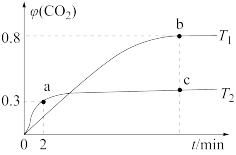
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
171次组卷
|
6卷引用:甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题
名校
解题方法
2 . 最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______ (填标号)。
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为___________ 、________________ ,制得等量H2所需能量系统I是系统II的_______ 倍。
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g) COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
①H2S的平衡转化率a1=_______ %,反应平衡常数K=______________ 。
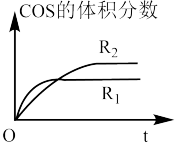
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________ (填字母序号)CO2的转化率a2__ a1,(填”>”或“<”)
A.压强B.温度C.催化剂
(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正___ V逆(填”>”或“<”)判断依据是___________________________ 。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是
A.H2S的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g)
 COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g)△H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02①H2S的平衡转化率a1=
②在不同条件下发生上述反应,COS的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是
A.压强B.温度C.催化剂

(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40molH2S、0.02molCOS和0.02molH2O,则此时V正
您最近一年使用:0次
2017-12-31更新
|
203次组卷
|
2卷引用:山西省祁县中学2018届高三12月月考化学试题
名校
解题方法
3 . Ⅰ 甲醇水蒸气重整制氢
甲醇水蒸气重整制氢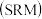 系统简单,产物中
系统简单,产物中 含量高、CO含量低
含量高、CO含量低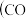 会损坏燃料电池的交换膜
会损坏燃料电池的交换膜 ,是电动汽车氢氧燃料电池理想的氢源。反应如下:
,是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应 主
主
反应 副
副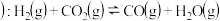
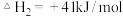
温度高于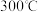 则会同时发生反应
则会同时发生反应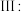
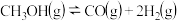

(1)计算反应III的
______________ 。
Ⅱ 太阳能电池可用作电解的电源
太阳能电池可用作电解的电源 如图
如图 。
。
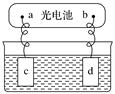
(2)若c、d均为惰性电极,电解质溶液为硫酸铜溶液,电解过程中,c极先无气体产生,后又生成气体,则c极为________ 极,在电解过程中,溶液的pH________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” ,停止电解后,为使溶液恢复至原溶液应加入适量的
,停止电解后,为使溶液恢复至原溶液应加入适量的____________________ 。
(3)若c、d均为铜电极,电解质溶液为氯化钠溶液,则电解时,溶液中氯离子的物质的量将________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
(4)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。其原理是加入试剂调节污水的pH在 。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色物质具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应为
。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色物质具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应为________ ;阳极区生成的有色物质是________ 。
Ⅲ 现有以下三种乙醇燃料电池
现有以下三种乙醇燃料电池 。
。
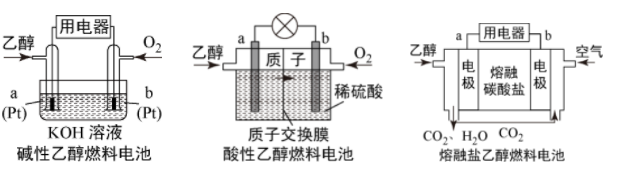
(5) 碱性乙醇燃料电池中,电极a上发生的电极反应式为
碱性乙醇燃料电池中,电极a上发生的电极反应式为___________________________ 。
 酸性乙醇燃料电池中,电极b上发生的电极反应式为
酸性乙醇燃料电池中,电极b上发生的电极反应式为___________________________ 。
 熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为
熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为__________ 。以此电源电解足量的硝酸银溶液,若阴极产物的质量为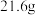 ,电解后溶液体积为2L,溶液的pH约为
,电解后溶液体积为2L,溶液的pH约为_____
 甲醇水蒸气重整制氢
甲醇水蒸气重整制氢 系统简单,产物中
系统简单,产物中 含量高、CO含量低
含量高、CO含量低 会损坏燃料电池的交换膜
会损坏燃料电池的交换膜 ,是电动汽车氢氧燃料电池理想的氢源。反应如下:
,是电动汽车氢氧燃料电池理想的氢源。反应如下: 反应
 主
主
反应
 副
副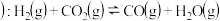
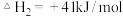
温度高于
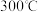 则会同时发生反应
则会同时发生反应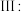
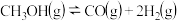

(1)计算反应III的

Ⅱ
 太阳能电池可用作电解的电源
太阳能电池可用作电解的电源 如图
如图 。
。
(2)若c、d均为惰性电极,电解质溶液为硫酸铜溶液,电解过程中,c极先无气体产生,后又生成气体,则c极为
 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” ,停止电解后,为使溶液恢复至原溶液应加入适量的
,停止电解后,为使溶液恢复至原溶液应加入适量的(3)若c、d均为铜电极,电解质溶液为氯化钠溶液,则电解时,溶液中氯离子的物质的量将
 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。(4)若用石墨、铁作电极材料,可组装成一个简易污水处理装置。其原理是加入试剂调节污水的pH在
 。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色物质具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应为
。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的有色物质具有吸附性,吸附污物而沉积,起到凝聚净化作用。该装置中,阴极的电极反应为Ⅲ
 现有以下三种乙醇燃料电池
现有以下三种乙醇燃料电池 。
。
(5)
 碱性乙醇燃料电池中,电极a上发生的电极反应式为
碱性乙醇燃料电池中,电极a上发生的电极反应式为 酸性乙醇燃料电池中,电极b上发生的电极反应式为
酸性乙醇燃料电池中,电极b上发生的电极反应式为 熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为
熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为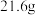 ,电解后溶液体积为2L,溶液的pH约为
,电解后溶液体积为2L,溶液的pH约为
您最近一年使用:0次
名校
4 . (1)已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N—H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)===2NH3(g)ΔH=-92.4 kJ/mol,可知 键的键能是
键的键能是______________ kJ/mol
(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+1/2O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入___ (“+”或“-”)。
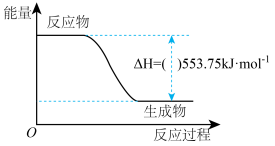
②写出表示丙烷燃烧热的热化学方程式:___________________________ 。
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
由以上表格中数据判断以下说法不正确的是__________ 。
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S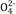
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是________________ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(CH3COO-) D.c(CH3COOH)
 键的键能是
键的键能是(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+1/2O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入

②写出表示丙烷燃烧热的热化学方程式:
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
由以上表格中数据判断以下说法不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S
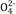
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(CH3COO-) D.c(CH3COOH)
您最近一年使用:0次
2017-11-18更新
|
156次组卷
|
3卷引用:贵州省遵义航天高级中学2017-2018学年高二上学期期中考试化学试题



