解题方法
1 . 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
(1)该反应的平衡常数表达式K=______ ;Q______ 0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___ υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=______ ;
(3)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________ 、____________ ;
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:
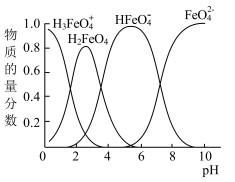
(i)pH=2时溶液存在如下等量关系: c(K+)=_____________ ;
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为_________ 。
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正
(3)已知:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:

(i)pH=2时溶液存在如下等量关系: c(K+)=
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为
您最近一年使用:0次



