1 . Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为____________________________ 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
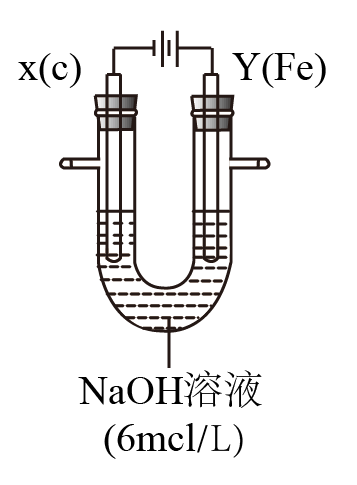
(4)电解过程中,X极区溶液的pH____________ (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和___________________ 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___________ g。
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届甘肃省嘉峪关一中高三上第三次模拟考试化学试卷
名校
解题方法
2 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
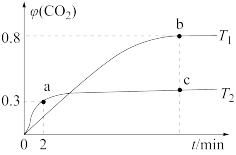
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
164次组卷
|
6卷引用:甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题
名校
3 . Ⅰ.氧、硫、硒、碲均位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确 的是_____ (填字母)。
A.酸性:H2SeO4 > H2SeO3 B.非金属性:O > S > Se > Te
C.还原性:H2Te > H2Se > H2S > H2O D.热稳定性:H2O > H2Te > H2Se > H2S
E.沸点:H2Te > H2Se > H2S > H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_____________________________________ 。
②若V是水,为还原产物,反应的化学方程式为_____________________________________ 。
(3)已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:________________________________________ 。
(4)工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________ 。
Ⅱ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是__________________ 。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
SO2(g)+CaO(s)==CaSO3(s) △H=-402 kJ·mol-1
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2 kJ·mol-1
写出石灰石脱硫的热化学反应方程式_______________________________________ 。
(1)下列性质的递变顺序
A.酸性:H2SeO4 > H2SeO3 B.非金属性:O > S > Se > Te
C.还原性:H2Te > H2Se > H2S > H2O D.热稳定性:H2O > H2Te > H2Se > H2S
E.沸点:H2Te > H2Se > H2S > H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为
②若V是水,为还原产物,反应的化学方程式为
(3)已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:
(4)工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为
Ⅱ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
SO2(g)+CaO(s)==CaSO3(s) △H=-402 kJ·mol-1
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2 kJ·mol-1
写出石灰石脱硫的热化学反应方程式
您最近一年使用:0次
4 . “循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是_______ (填选项字母)。
A. 有漂白性而
有漂白性而 没有
没有
B.少量 能与
能与 反应生成
反应生成
C. 能使酸性
能使酸性 溶液褪色而
溶液褪色而 不能
不能
D. 溶液显碱性而
溶液显碱性而 溶液显中性
溶液显中性
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_______ ;两个系统制得等量的H2所需能量较少的是_______ 。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
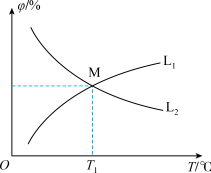
①图中能表示CO的平衡体积分数与温度关系的曲线为_______ (填“L1”或“L2”)。
②T1 ℃时, 的平衡转化率α1=
的平衡转化率α1=_______ ,反应的平衡常数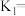
_______ 。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_______ (填选项字母)。
A.增大压强 B.充入一定量 C. 充入一定量
C. 充入一定量 D.加入适当催化剂
D.加入适当催化剂
④向起始温度为 ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol  ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数
_______  (填“>”“<”或“=”),理由为
(填“>”“<”或“=”),理由为_______ 。
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是
A.
 有漂白性而
有漂白性而 没有
没有B.少量
 能与
能与 反应生成
反应生成
C.
 能使酸性
能使酸性 溶液褪色而
溶液褪色而 不能
不能D.
 溶液显碱性而
溶液显碱性而 溶液显中性
溶液显中性(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol
 ,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
①图中能表示CO的平衡体积分数与温度关系的曲线为
②T1 ℃时,
 的平衡转化率α1=
的平衡转化率α1=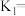
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是
A.增大压强 B.充入一定量
 C. 充入一定量
C. 充入一定量 D.加入适当催化剂
D.加入适当催化剂④向起始温度为
 ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol  ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数
 (填“>”“<”或“=”),理由为
(填“>”“<”或“=”),理由为
您最近一年使用:0次
名校
解题方法
5 . 燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=________ kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________ ;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________ α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________ (填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________ ,t6时刻改变的条件是________ ,t4时刻改变条件后v(正) ________ v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________ (列出计算式即可)。
回答下列问题:
(1)已知SO2(g)+O3(g)
 SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1NO(g)+O3(g)
 NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1 则反应SO3(g)+NO(g)
 SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g)
 NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。①25℃时,0.1mol·L-1(NH4)2SO3溶液呈
②计算第2步反应的平衡常数K=
您最近一年使用:0次
2019-01-12更新
|
457次组卷
|
3卷引用:甘肃省武威市第六中学2019届高三下学期第一次诊断考试化学试题
2014·北京石景山·一模
6 . 氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为__________ 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________ kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为________ (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是__________ (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为:_____________ 。
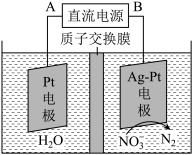
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为:___________ (选填“A”或“B”),阴极反应式为:________________ 。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为
NO2 + G
 N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为:
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为:

您最近一年使用:0次



