名校
1 . 硫是一种重要的非金属元素,正交硫(Orthogonal sulfur)是硫稳定存在的唯一形式,单斜硫是硫的同素异形体之一。下列说法不正确 的是
已知:①S(正交,s)+O2(g)=SO2(g)ΔH1=-296.83kJ•mol-1
②S(单斜,s)+O2(g)=SO2(g)ΔH2=-297.16kJ•mol-1
③S(单斜,s)=S(正交,s)ΔH3
已知:①S(正交,s)+O2(g)=SO2(g)ΔH1=-296.83kJ•mol-1
②S(单斜,s)+O2(g)=SO2(g)ΔH2=-297.16kJ•mol-1
③S(单斜,s)=S(正交,s)ΔH3
| A.硫黄是一种黄色晶体,不溶于水 |
| B.正交硫比单斜硫稳定 |
| C.ΔH3=-0.66kJ•mol -1, |
| D.1mol S(单斜,s)和1mol O2(g)的总能量高于1mol SO2(g)的能量 |
您最近一年使用:0次
2021-05-20更新
|
463次组卷
|
6卷引用:云南省富源县第一中学2020-2021学年高二上学期9月月考化学试题
云南省富源县第一中学2020-2021学年高二上学期9月月考化学试题黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题重庆市普通高中学业水平选择性考试2021届高三第三次联合诊断检测化学试题(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省红安县第一中学2022-2023学年高二上学期9月考试化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
10-11高一下·辽宁大连·期末
名校
解题方法
2 . 已知下列热化学方程式: Hg(l)+ O2(g)=HgO(s) △H1;
O2(g)=HgO(s) △H1;
Zn(s)+ O2(g)=ZnO(s) △H2;
O2(g)=ZnO(s) △H2;
则Zn(s)+HgO(s)= Hg(l)+ZnO(s) △H值为
 O2(g)=HgO(s) △H1;
O2(g)=HgO(s) △H1;Zn(s)+
 O2(g)=ZnO(s) △H2;
O2(g)=ZnO(s) △H2;则Zn(s)+HgO(s)= Hg(l)+ZnO(s) △H值为
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
您最近一年使用:0次
2021-05-07更新
|
474次组卷
|
9卷引用:2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试
(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2013-2014学年江西省新余市高二上学期期末考试化学试卷2015-2016学年江苏省泰兴高级中学高二上学期期中测试化学试卷广西贺州市中学2020-2021学年高二上学期第三次月考化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题江苏省马坝高级中学2020-2021学年高二下学期期中考试化学试题(已下线)第1章能力提升测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
名校
解题方法
3 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
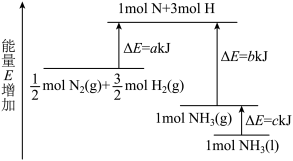
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题
山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:
Ⅰ.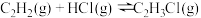
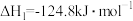
Ⅱ.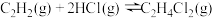
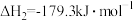
Ⅲ.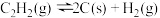

Ⅳ.部分化学键的键能如表所示。
回答下列问题:
(1)表中x=______ 。
(2)较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为 充入
充入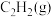 和
和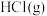 ,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为
,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为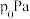 ,10min达到平衡时
,10min达到平衡时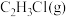 、HCl(g)的分压分别为
、HCl(g)的分压分别为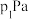 、
、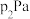 。
。
①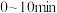 内,反应的平均速率
内,反应的平均速率
______ 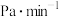 (用分压表示,下同)。
(用分压表示,下同)。
②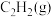 的平衡转化率为
的平衡转化率为______ 。
③反应Ⅰ的平衡常数
______ 。
(3)高温度下,会发生反应Ⅲ而形成积碳,其可能导致的后果为______ (答出一点即可);不同压强下,向盛放催化剂的密闭容器中以物质的量之比为 充入
充入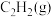 和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。
和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。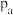 、
、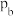 、
、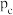 由大到小的顺序为
由大到小的顺序为______ ;随温度升高,三条曲线逐渐趋于重合的原因为______ 。

(4)结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是______ (填选项字母)。
A.该历程中的最大能垒为
B.存在非极性键断裂和极性键形成
C.选择不同催化剂,最大能垒不发生变化
Ⅰ.
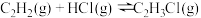
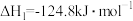
Ⅱ.
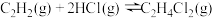
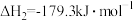
Ⅲ.
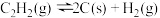

Ⅳ.部分化学键的键能如表所示。
| 化学键 | 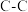 | 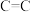 |  | 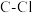 |  |
键能 | 347.7 | x | 413.4 | 340.2 | 431.8 |
(1)表中x=
(2)较低温度下乙炔选择性催化加氢过程只发生反应Ⅰ和Ⅱ。一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为
 充入
充入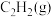 和
和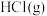 ,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为
,发生反应Ⅰ和Ⅱ。实验测得反应前容器内压强为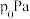 ,10min达到平衡时
,10min达到平衡时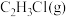 、HCl(g)的分压分别为
、HCl(g)的分压分别为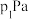 、
、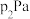 。
。①
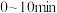 内,反应的平均速率
内,反应的平均速率
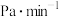 (用分压表示,下同)。
(用分压表示,下同)。②
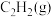 的平衡转化率为
的平衡转化率为③反应Ⅰ的平衡常数

(3)高温度下,会发生反应Ⅲ而形成积碳,其可能导致的后果为
 充入
充入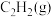 和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。
和HCl(g)发生反应,实验测得乙炔的平衡转化率与温度的关系如图1所示。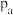 、
、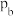 、
、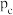 由大到小的顺序为
由大到小的顺序为
(4)结合试验和计算机模拟结果,有学者提出乙炔选择性催化加氢的反应历程,如图2所示,其中吸附在催化剂表面的物种用“*”标注,TS表示过渡态。下列说法正确的是
A.该历程中的最大能垒为

B.存在非极性键断裂和极性键形成
C.选择不同催化剂,最大能垒不发生变化
您最近一年使用:0次
2021-04-10更新
|
711次组卷
|
8卷引用:2020年山东卷化学高考真题变式题16-20
(已下线)2020年山东卷化学高考真题变式题16-20黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期末考试化学试题河北省张家口市2021届高三第二次模拟考试化学试题河北省承德市2021届高三下学期第二次模拟考试化学试题(已下线)2021年高考化学押题预测卷(河北卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题湖南省益阳市沅江市第一中学2022届高三下学期第二次模拟考试试题
名校
解题方法
5 . 完成下列反应的热化学方程式。
(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为_____________ 。
(2)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式_________________________ 。
(3)已知: N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+a kJ·mol-1
H2(g)=N(g)+3H(g) ΔH1=+a kJ·mol-1
N(g)+3H(g)=NH3(g) ΔH2=-b kJ·mol-1
NH3(g)=NH3(l) ΔH3=-c kJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式__________________________________ 。
(4)已知:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
试写出HF电离的热化学方程式_____________________________________________ 。
(5)SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式___________________________________________ 。
(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为
(2)已知H2S完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式
(3)已知:
 N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+a kJ·mol-1
H2(g)=N(g)+3H(g) ΔH1=+a kJ·mol-1N(g)+3H(g)=NH3(g) ΔH2=-b kJ·mol-1
NH3(g)=NH3(l) ΔH3=-c kJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式
(4)已知:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
试写出HF电离的热化学方程式
(5)SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
2021-01-30更新
|
2791次组卷
|
7卷引用:山西省沁县中学2020-2021学年高二上学期第一次月考化学试题
山西省沁县中学2020-2021学年高二上学期第一次月考化学试题黑龙江省大庆铁人中学2022-2023学年高一下学期期中考试化学试题(已下线)1.1.3 能源的充分利用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)期中测试卷01-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)(已下线)期中试卷01-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
名校
解题方法
6 . 已知: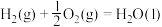
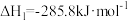 ①
①
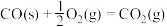
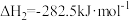 ②
②

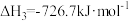 ③
③
 和
和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: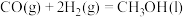
 ,则
,则 为
为
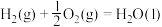
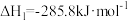 ①
①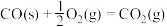
 ②
②
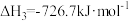 ③
③ 和
和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: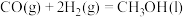
 ,则
,则 为
为A. | B. |
C. | D.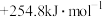 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法不正确的是
| A.化学反应中一定伴随能量变化 |
| B.S在纯氧中燃烧是将全部化学能转化为热能 |
| C.物质所含化学键键能越大,其越稳定 |
| D.化学反应的∆H,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2021-01-28更新
|
908次组卷
|
7卷引用:黑龙江省嫩江市高级中学2020-2021学年高二上学期9月月考化学试题
黑龙江省嫩江市高级中学2020-2021学年高二上学期9月月考化学试题课前-1.2 反应热的计算-课前、课中、课后(人教版2019选择性必修1)(已下线)第1章 化学反应的热效应(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题山东省济宁市微山县第二中学2021-2022学年高二上学期第一学段考试化学试题陕西省榆林市子洲中学2021-2022学年高二上学期期中考试化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期第一次月考化学试题
8 . 据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式_______ 。
II.为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入2molCO和2molNO,发生反应 ,如图为平衡时的体积分数与温度、压强的关系。
,如图为平衡时的体积分数与温度、压强的关系。

(1)该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有_______ (填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
(2)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮( ),其工作原理如图所示
),其工作原理如图所示
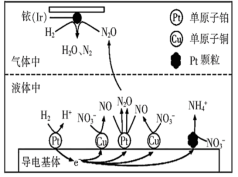
Ir表面发生反应的方程式为_______ ;若导电基体上的Pt颗粒增多,造成的后果是_______ 。
(3)在恒温恒压的条件下,向密闭容器中充入2molNO和2molCO发生反应,此时容器体积为1L,在tl时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K为_______
(4)在t1将容器迅速压缩到原容积的 ,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,逆反应速率的变化曲线
,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,逆反应速率的变化曲线_______ 。

(5)使用间接电化学法可处理燃煤烟气中的NO,装置如图所示。

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_______ 。用离子方程式表示吸收池中除去NO的原理_______ 。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式
II.为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入2molCO和2molNO,发生反应
 ,如图为平衡时的体积分数与温度、压强的关系。
,如图为平衡时的体积分数与温度、压强的关系。
(1)该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
(2)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(
 ),其工作原理如图所示
),其工作原理如图所示
Ir表面发生反应的方程式为
(3)在恒温恒压的条件下,向密闭容器中充入2molNO和2molCO发生反应,此时容器体积为1L,在tl时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K为
(4)在t1将容器迅速压缩到原容积的
 ,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,逆反应速率的变化曲线
,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,逆反应速率的变化曲线
(5)使用间接电化学法可处理燃煤烟气中的NO,装置如图所示。

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式
您最近一年使用:0次
9 . 研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义,请回答下列问题:
I.为减少SO2的排放,将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=-110.4 kJ·mol-1
O2(g)=CO(g) ΔH=-110.4 kJ·mol-1
(1)写出焦炭与水蒸气反应的热化学方程式_________________________ 。
(2)洗涤含SO2的烟气,含以下物质的溶液可作洗涤剂的是____________________ 。
A.NaHSO3 B.NaHCO3 C.BaCl2 D.FeCl3
II.NOx是汽车尾气中的主要污染物之一。
(3)汽车尾气中生成NO的反应为:N2(g)+O2(g)⇌2NO(g) ΔH>0
①T ℃时,2 L密闭气缸中充入4 mol N2和1 mol O2发生反应,5 min后达平衡,测得NO为1 mol。计算该温度下,N2的平均反应速率v(N2)=_______________ ,反应的平衡常数K=____________ 。
②如图曲线 a 表示该反应在温度T ℃下N2的物质的量随时间的变化,曲线 b 表示该反应在某一起始条件改变时N2的物质的量随时间的变化,则改变的条件可能是____________ (写出一条即可)III.汽车燃油不完全燃烧时会产生CO。

(4)有人设想按2CO(g)=2C(s)+O2(g)反应除去CO,但事实上该反应在任何温度下都不能实现,由此判断该反应的ΔH_______ 0。(填写“>”、“<”或者“=”)
(5)在汽车尾气系统中安装催化转化器可降低尾气中污染物的排放,其反应为:2NO(g)+2CO(g)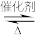 2CO2(g)+N2(g)。已知该反应在570 K时的平衡常数的数值为1×1059,但反应速率极慢。为了提高尾气的净化效率在实际操作中最可行的措施是
2CO2(g)+N2(g)。已知该反应在570 K时的平衡常数的数值为1×1059,但反应速率极慢。为了提高尾气的净化效率在实际操作中最可行的措施是_____ 。
A.升高温度 B.增大压强 C.使用高效催化剂
I.为减少SO2的排放,将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C(s)+
 O2(g)=CO(g) ΔH=-110.4 kJ·mol-1
O2(g)=CO(g) ΔH=-110.4 kJ·mol-1 (1)写出焦炭与水蒸气反应的热化学方程式
(2)洗涤含SO2的烟气,含以下物质的溶液可作洗涤剂的是
A.NaHSO3 B.NaHCO3 C.BaCl2 D.FeCl3
II.NOx是汽车尾气中的主要污染物之一。
(3)汽车尾气中生成NO的反应为:N2(g)+O2(g)⇌2NO(g) ΔH>0
①T ℃时,2 L密闭气缸中充入4 mol N2和1 mol O2发生反应,5 min后达平衡,测得NO为1 mol。计算该温度下,N2的平均反应速率v(N2)=
②如图曲线 a 表示该反应在温度T ℃下N2的物质的量随时间的变化,曲线 b 表示该反应在某一起始条件改变时N2的物质的量随时间的变化,则改变的条件可能是

(4)有人设想按2CO(g)=2C(s)+O2(g)反应除去CO,但事实上该反应在任何温度下都不能实现,由此判断该反应的ΔH
(5)在汽车尾气系统中安装催化转化器可降低尾气中污染物的排放,其反应为:2NO(g)+2CO(g)
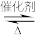 2CO2(g)+N2(g)。已知该反应在570 K时的平衡常数的数值为1×1059,但反应速率极慢。为了提高尾气的净化效率在实际操作中最可行的措施是
2CO2(g)+N2(g)。已知该反应在570 K时的平衡常数的数值为1×1059,但反应速率极慢。为了提高尾气的净化效率在实际操作中最可行的措施是A.升高温度 B.增大压强 C.使用高效催化剂
您最近一年使用:0次
2021-01-14更新
|
402次组卷
|
6卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
黑龙江省大庆市2020届高三第一次质量检测化学试题甘肃省白银市会宁县第四中学2021届高三上学期第四次月考化学试题(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(反应原理-氧化还原反应)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)
2019高二·全国·专题练习
名校
10 . 下列关于盖斯定律描述不正确的是
| A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B.盖斯定律遵守能量守恒定律 |
| C.利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D.利用盖斯定律可以计算有副反应发生的反应的反应热 |
您最近一年使用:0次
2021-01-06更新
|
578次组卷
|
18卷引用:黑龙江省哈尔滨师范大学附属中学2019-2020学年高一下学期期末考试化学试题
黑龙江省哈尔滨师范大学附属中学2019-2020学年高一下学期期末考试化学试题(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用(已下线)1.2.1 盖斯定律(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时4 反应焓变的计算(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)四川省阆中东风中学校2020-2021学年高二上学期第三学月调研监测化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河南省浉河区新时代学校2021-2022学年高二上学期第一次月考化学试题(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)贵州省黔西南州兴义市同源中学2021-2022学年高二上学期期中考试化学试题河北省石家庄市第二十一中学2022-2023学年高二上学期十月月考化学试题第3课时 反应焓变的计算河南省开封高级中学2023-2024学年高三上学期第一次质量检测化学试题河南省濮阳市2023-2024学年高二上学期9月月考化学试题陕西省西安市长安区2023-2024学年高二上学期10月份月考化学试题【精品卷】1.2.1 盖斯定律课堂例题-人教版2023-2024学年选择性必修1四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题



