名校
解题方法
1 . 生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.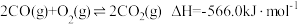
Ⅱ.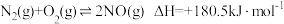
Ⅲ.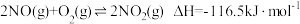
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是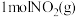 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 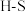 |  |  |  中共价键 中共价键 |
键能/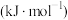 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
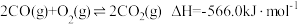
Ⅱ.
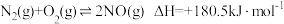
Ⅲ.
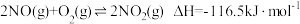
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
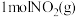 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
解题方法
2 . 发射卫星时可用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ•mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ•mol-1
F2(g)=HF(g) ΔH=-269kJ•mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1
肼和二氧化氮反应的热化学方程式为_______ 。
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ•mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g) ΔH=-269kJ•mol-1
F2(g)=HF(g) ΔH=-269kJ•mol-1H2(g)+
 O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1肼和二氧化氮反应的热化学方程式为
您最近一年使用:0次
3 . 已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=−870.3 kJ∙mol−1
(2)C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
(3)H2(g)+ O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1试计算下列反应的反应热:
O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=_______ 。
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=−870.3 kJ∙mol−1
(2)C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
(3)H2(g)+
 O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1试计算下列反应的反应热:
O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
您最近一年使用:0次
名校
解题方法
4 . 硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。
(1)接触室中发生的反应:
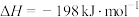 。
。
①若测得2h后 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为_________  。
。
②将0.050mol (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测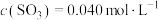 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K=_________ , 的平衡转化率为
的平衡转化率为_________ 。
③ 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为_________ 。
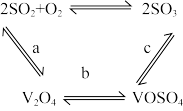
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
(3)为减少 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:
恒容、恒温( )条件下,反应体系中
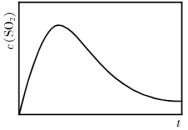
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:_________ 。
(1)接触室中发生的反应:

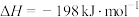 。
。①若测得2h后
 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为 。
。②将0.050mol
 (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测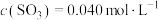 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K= 的平衡转化率为
的平衡转化率为③
 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为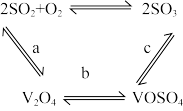
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
| A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 |
| B.气体在进接触室前要先净化,可防止催化剂中毒 |
| C.接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 |
D.吸收塔中操作采取逆流的形式, 从下而上,水从上而下 从下而上,水从上而下 |
 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:| 反应 | 活化能 | 平衡常数 | |
| Ⅰ |  | 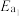 | 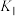 |
| Ⅱ |  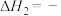 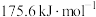 | 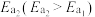 | 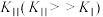 |
恒容、恒温(
 )条件下,反应体系中
)条件下,反应体系中 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析 随时间t变化的原因:
随时间t变化的原因:
您最近一年使用:0次
2022-12-05更新
|
36次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
5 . 化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。燃烧a g 生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的
生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的 与足量澄清石灰水反应得到5g沉淀,则
与足量澄清石灰水反应得到5g沉淀,则
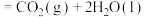

_________  ,其中
,其中
_________ 。
(2)以太阳能为热源,经由铁氧化合物循环分解液态水的过程如图所示。已知:

过程Ⅰ:
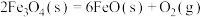
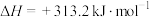
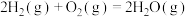


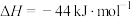
①氢气的燃烧热
_________  。
。
②过程Ⅱ的热化学方程式为_________ 。
(3)通氧气自热法生产 包含下列反应:
包含下列反应:
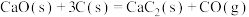


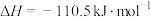
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO。为了维持热平衡,每生产1mol ,投料的量为1mol CaO、
,投料的量为1mol CaO、_________ mol C及_________ mol  。
。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。燃烧a g
 生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的
生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的 与足量澄清石灰水反应得到5g沉淀,则
与足量澄清石灰水反应得到5g沉淀,则
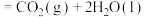

 ,其中
,其中
(2)以太阳能为热源,经由铁氧化合物循环分解液态水的过程如图所示。已知:

过程Ⅰ:
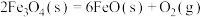
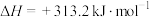
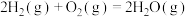


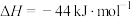
①氢气的燃烧热

 。
。②过程Ⅱ的热化学方程式为
(3)通氧气自热法生产
 包含下列反应:
包含下列反应: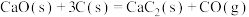


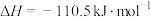
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO。为了维持热平衡,每生产1mol
 ,投料的量为1mol CaO、
,投料的量为1mol CaO、 。
。
您最近一年使用:0次
2022-12-05更新
|
88次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
6 . 开发新能源是解决环境污染的重要举措,工业常用 与
与 反应制备
反应制备 和
和 ,再利用
,再利用 和
和 合成甲醇。
合成甲醇。
(1)已知:①
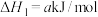
②
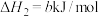
③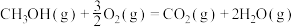
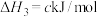
则

_________  。
。
(2)下列能说明反应 已达到平衡状态的是
已达到平衡状态的是_________ (填字母)。
a.单位时间内生成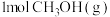 的同时消耗
的同时消耗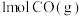
b.在恒温恒容的容器中,混合气体的密度保持不变
c.在绝热恒容的容器中,反应的平衡常数不再变化
d.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在恒容密闭容器中通入 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为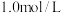 ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 的平衡转化率与温度及压强的关系如图1所示:
的平衡转化率与温度及压强的关系如图1所示:
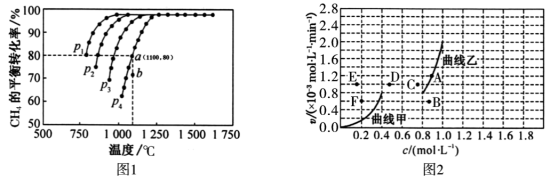
①该反应的
_________ 0(填“>”、“<”或“=”)。
②压强 、
、 、
、 、
、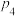 由大到小的顺序力
由大到小的顺序力_________ 。压强为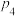 时,在b点:
时,在b点:
_________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③对于气相反应,用某组分(B)的平衡压强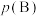 代替物质的量浓度
代替物质的量浓度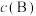 也可表示平衡常数(记作
也可表示平衡常数(记作 )。若
)。若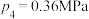 ,则a点的平衡常数
,则a点的平衡常数
_________ (结果精确到0.01,分压=总压×物质的量分数)。
④为探究该实验中速率与浓度的关系,根据相关实验数据,粗略绘制出了2条速率与浓度的关系曲线: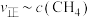 和
和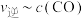 (如图2)。则与曲线
(如图2)。则与曲线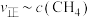 相对应的是图2中的曲线
相对应的是图2中的曲线_________ (填“甲”或“乙”)。当降低到某一温度时,反应重新达到平衡, 、
、 相应的平衡点分别为
相应的平衡点分别为_________ (填字母)。
 与
与 反应制备
反应制备 和
和 ,再利用
,再利用 和
和 合成甲醇。
合成甲醇。(1)已知:①

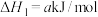
②

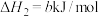
③
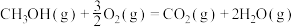
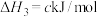
则


 。
。(2)下列能说明反应
 已达到平衡状态的是
已达到平衡状态的是a.单位时间内生成
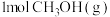 的同时消耗
的同时消耗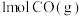
b.在恒温恒容的容器中,混合气体的密度保持不变
c.在绝热恒容的容器中,反应的平衡常数不再变化
d.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在恒容密闭容器中通入
 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为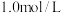 ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 的平衡转化率与温度及压强的关系如图1所示:
的平衡转化率与温度及压强的关系如图1所示:
①该反应的

②压强
 、
、 、
、 、
、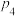 由大到小的顺序力
由大到小的顺序力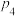 时,在b点:
时,在b点:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③对于气相反应,用某组分(B)的平衡压强
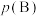 代替物质的量浓度
代替物质的量浓度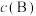 也可表示平衡常数(记作
也可表示平衡常数(记作 )。若
)。若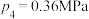 ,则a点的平衡常数
,则a点的平衡常数
④为探究该实验中速率与浓度的关系,根据相关实验数据,粗略绘制出了2条速率与浓度的关系曲线:
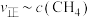 和
和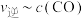 (如图2)。则与曲线
(如图2)。则与曲线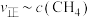 相对应的是图2中的曲线
相对应的是图2中的曲线 、
、 相应的平衡点分别为
相应的平衡点分别为
您最近一年使用:0次
7 . Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______
Ⅱ.甲醇是一种重要的可再生能源。
(2)已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a kJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ/mol
写出由CH4和O2制取甲醇的热化学方程式_______ 。
(3)通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)_______ 。
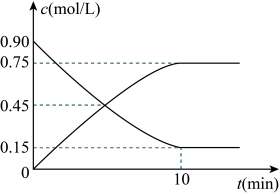
(4)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示

①下列说法能判断该反应达到化学平衡状态的是_______ (填字母序号)。
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等 D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)_______ P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积为_______ L。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
Ⅱ.甲醇是一种重要的可再生能源。
(2)已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a kJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ/mol
写出由CH4和O2制取甲醇的热化学方程式
(3)通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
(4)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示

①下列说法能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等 D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积为
您最近一年使用:0次
名校
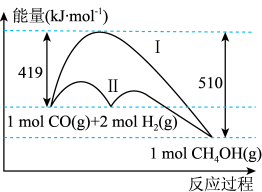
8 . 能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
(1)工业上用CO生产燃料甲醇,一定条件下发生反应: ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线_______ (选填“Ⅰ”或“Ⅱ”)表示使用催化剂的反应过程。计算当反应生成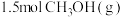 时,能量变化值是
时,能量变化值是_______ kJ。
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有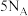 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为_______ 。
(3)已知拆开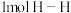 键、
键、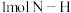 键、
键、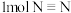 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成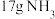 需放出的热量为
需放出的热量为_______ kJ。
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
已知:①

②

③

④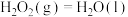

则表示 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为_______  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(5)已知乙醇的燃烧热为 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是_______  。(取小数点后一位)
。(取小数点后一位)
(1)工业上用CO生产燃料甲醇,一定条件下发生反应:
 ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线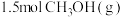 时,能量变化值是
时,能量变化值是
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有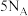 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为(3)已知拆开
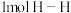 键、
键、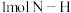 键、
键、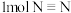 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成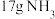 需放出的热量为
需放出的热量为(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用
 生产甲醇燃料的方法:
生产甲醇燃料的方法:已知:①


②


③


④
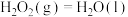

则表示
 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为 (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。(5)已知乙醇的燃烧热为
 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是 。(取小数点后一位)
。(取小数点后一位)
您最近一年使用:0次
名校
9 . 如图表示甲、乙、丙三个过程的能量变化(其中 、
、 、HCl均为气态)。下列有关说法正确的是
、HCl均为气态)。下列有关说法正确的是
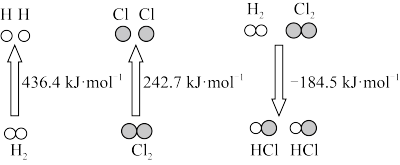
 、
、 、HCl均为气态)。下列有关说法正确的是
、HCl均为气态)。下列有关说法正确的是
A.H原子形成 吸收436.4kJ的能量 吸收436.4kJ的能量 |
B.反应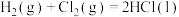 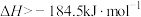 |
C.氯化氢分子的电子式: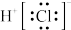 |
D.由图中信息可以计算气态原子形成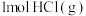 中化学键所释放的能量 中化学键所释放的能量 |
您最近一年使用:0次
名校
10 . 回答下列问题
(1)25℃、101KPa下,1g乙醇燃烧生成二氧化碳和液态水时放热29.71kJ,写出乙醇燃烧的热化学方程式___________ 。
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一、
已知:CO(g)+2H2(g)=CH3OH(g) △H=a kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=b kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=c kJ/mol
则CO2和氢气合成CH3OCH3(g)的热化学方程式为___________ 。
(3)利用下图装置测定中和热的实验步骤如下:
a.量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
b.量取50mL 0.55mol/L NaOH溶液,测量温度;
c.将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:

①如图所示,仪器A的名称是___________ ;
②NaOH溶液稍过量的原因___________ ;
③写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(已知:中和热数值约为57.3kJ/mol)___________ ;
④上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___________ ;
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___________ (填“偏大”“偏小”或“无影响”),原因为___________ ;
⑥___________ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和硫酸,理由是___________ 。
(1)25℃、101KPa下,1g乙醇燃烧生成二氧化碳和液态水时放热29.71kJ,写出乙醇燃烧的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一、
已知:CO(g)+2H2(g)=CH3OH(g) △H=a kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=b kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=c kJ/mol
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
(3)利用下图装置测定中和热的实验步骤如下:
a.量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
b.量取50mL 0.55mol/L NaOH溶液,测量温度;
c.将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:

①如图所示,仪器A的名称是
②NaOH溶液稍过量的原因
③写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(已知:中和热数值约为57.3kJ/mol)
④上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
⑥
您最近一年使用:0次



