名校
解题方法
1 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和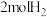 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得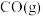 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
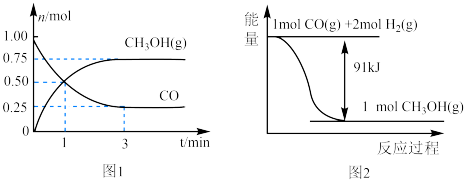
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率
_____ ;能说明该反应已经达到平衡状态的是_____ 。
a.
b.容器内压强保持不变
c.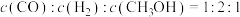
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时 的转化率为
的转化率为_____ ,该条件下此反应的平衡常数为_____ 。
(3)根据图2,计算当反应生成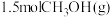 时,能量变化值是
时,能量变化值是_____ kJ。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和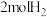 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得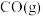 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率

a.

b.容器内压强保持不变
c.
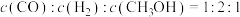
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时
 的转化率为
的转化率为(3)根据图2,计算当反应生成
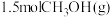 时,能量变化值是
时,能量变化值是
您最近一年使用:0次
名校
2 . Ⅰ.肼(N2H4)是一种重要的化工产品,有广泛用途,常用于火箭推进剂和燃料电池。回答下列问题:
(1)N2H4的电子式为________ 。
(2)已知N2H4(g)+O2(g)=N2(g)+2H2O(g)的能量变化如图所示:
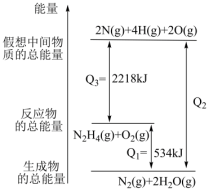
①则该反应为______ (填“吸热反应”或“放热反应”)。
②2molN原子、4molH原子、2molO原子生成1molN2(g)和2molH2O(g)的过程中放出_____ kJ能量。
Ⅱ.“绿色办奥”是北京冬奥会四大办奥理念之首,在“双碳”目标驱动下,全球首次服务体育赛事的大批量氢燃料客车在北京冬奥会上闪亮登场。工作原理如图所示:
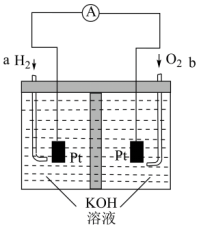
(3)氢燃料电池工作时H2从______ (填“正极”或“负极”)通入。
(4)负极发生的反应方程式为_______ 。
(5)溶液中OH-向_____ 电极(填“a”或“b”)移动。
(6)当有16g气体被还原时,回路中转移的电子数为_____ 。
(1)N2H4的电子式为
(2)已知N2H4(g)+O2(g)=N2(g)+2H2O(g)的能量变化如图所示:

①则该反应为
②2molN原子、4molH原子、2molO原子生成1molN2(g)和2molH2O(g)的过程中放出
Ⅱ.“绿色办奥”是北京冬奥会四大办奥理念之首,在“双碳”目标驱动下,全球首次服务体育赛事的大批量氢燃料客车在北京冬奥会上闪亮登场。工作原理如图所示:

(3)氢燃料电池工作时H2从
(4)负极发生的反应方程式为
(5)溶液中OH-向
(6)当有16g气体被还原时,回路中转移的电子数为
您最近一年使用:0次
2024-01-06更新
|
51次组卷
|
2卷引用:四川省安岳中学2023-2024学年高三10月月考理科综合试题
名校
3 . C、Si同处于IVA族,它们的单质或化合物有重要用途。实验室可用CO2回收废液中的苯酚,工业上用SiO2和焦炭高温下反应制得粗硅,再经如下2步反应制得精硅:Si(s)+3HCl(g)= SiHCl3(g)+H2(g) △H= -141.8 kJ·mol-1,SiHCl3(g)+ H2(g)= Si(s)+3HCl(g),反应过程中可能会生成SiCl4。有关反应Si(s)+3HCl(g) SiHCl3(g)+H2(g)的说法正确的是
SiHCl3(g)+H2(g)的说法正确的是
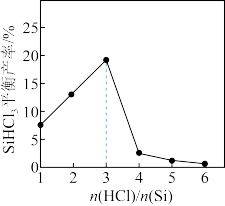
 SiHCl3(g)+H2(g)的说法正确的是
SiHCl3(g)+H2(g)的说法正确的是
| A.该反应的△H<0,△S>0 |
| B.其他条件不变,增大压强SiHCl3平衡产率减小 |
| C.实际工业生产选择高温,原因是高温时Si的平衡转化率比低温时大 |
D.如图所示,当 >3,SiHCl3平衡产率减小说明发生了副反应 >3,SiHCl3平衡产率减小说明发生了副反应 |
您最近一年使用:0次
2022-05-07更新
|
662次组卷
|
5卷引用:江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题
江苏省苏锡常镇四市2022届高三下学期教学情况调研(二)化学试题江苏省苏锡常镇四市2021-2022学年高三下学期5月教学情况调研(二)化学试题 江苏省盐城市阜宁县东沟中学2021-2022学年高三下学期第四次综合训练化学试题湖南省株洲市攸攸县第二中学2022-2023学年高三上学期第五次月考化学试题(已下线)第20练 新高考模式综合练(江苏卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
4 . 过二硫酸盐在工业上用途广泛,用作强氧化剂等。用过二硫酸盐(含Fe3+)去除溶液中I-的反应原理: (aq)+2I-(aq)=2
(aq)+2I-(aq)=2 (aq)+I2(aq)。该反应的分步机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)。该反应的分步机理如下,反应进程中的能量变化如图所示。
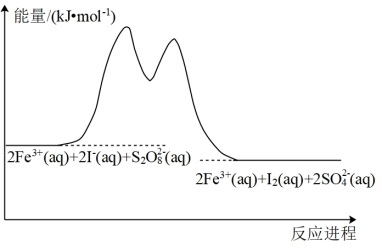
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq) Ea1
步骤②: (aq)+2Fe2+(aq)=2
(aq)+2Fe2+(aq)=2 (aq)+2Fe3+(aq) Ea2
(aq)+2Fe3+(aq) Ea2
下列关于该反应的说法错误的是
 (aq)+2I-(aq)=2
(aq)+2I-(aq)=2 (aq)+I2(aq)。该反应的分步机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)。该反应的分步机理如下,反应进程中的能量变化如图所示。
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq) Ea1
步骤②:
 (aq)+2Fe2+(aq)=2
(aq)+2Fe2+(aq)=2 (aq)+2Fe3+(aq) Ea2
(aq)+2Fe3+(aq) Ea2下列关于该反应的说法错误的是
| A.相同条件下,活化能Ea1>Ea2,所以②比①反应速率慢,是决速步骤 |
| B.图中△H<0,其大小与Ea1、Ea2无关 |
| C.步骤①为吸热反应、步骤②为放热反应 |
| D.Fe3+是该反应的催化剂 |
您最近一年使用:0次
2022-03-17更新
|
178次组卷
|
2卷引用:湖南省长沙市第一中学2021-2022学年高三上学期第五次月考化学试题
真题
5 . 镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的__ ,还生成少量的__ (填化学式)。
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是___ ,该化合物水解的化学方程式为___ 。
(3)如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
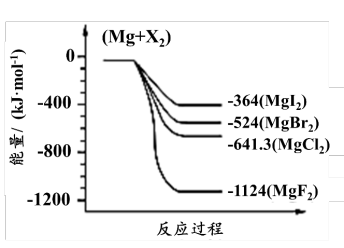
下列选项中正确的是__ (填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
(1)单质镁在空气中燃烧的主要产物是白色的
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
(3)如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

下列选项中正确的是
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
您最近一年使用:0次
名校
解题方法
6 . 甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。一定条件下,在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: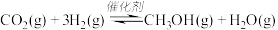 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:

(1)该反应为_____ (填放热或吸热)反应。
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=___ ,容器内平衡时与起始时的压强之比为____ 。
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是____ (填写序号字母)。
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c. 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d. 的比值保持不变
的比值保持不变
(4)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则_____ (填“A”或“B”)处电极入口通甲醇,当电路中通过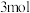 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为_____ 克。
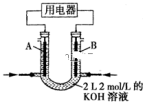
(5)下列化学电池不易造成环境污染的是____ (填字母)。
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为: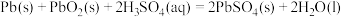 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为__________ 。
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,发生反应:
,发生反应: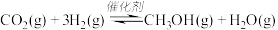 ,测得
,测得 的物质的量随时间变化如表所示,该反应的能量变化如图所示:
的物质的量随时间变化如表所示,该反应的能量变化如图所示:
 | 0 | 2 | 5 | 10 | 15 |
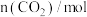 | 2 | 0.75 | 0.5 | 0.25 | 0.25 |
(1)该反应为
(2)从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是
a.容器内的平均相对分子质量保持不变 b.容器内压强保持不变
c.
 的消耗速率与
的消耗速率与 的生成速率之比为3:1 d.
的生成速率之比为3:1 d.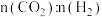 的比值保持不变
的比值保持不变(4)将
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得电池工作时OHˉ向B电极定向移动,则 电子时,理论上消耗
电子时,理论上消耗 质量为
质量为
(5)下列化学电池不易造成环境污染的是
A.甲醇氧气燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
铅蓄电池是最常见的二次电池,放电时的化学方程式为:
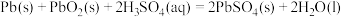 。该蓄电池放电时,正极电极反应方程式为
。该蓄电池放电时,正极电极反应方程式为
您最近一年使用:0次
2020-07-29更新
|
138次组卷
|
3卷引用: 重庆市万州第二高级中学2022-2023学年高三下学期2月月考化学试题



