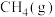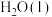1 . 科学家利用多种催化剂,实现甲烷和 的超干重整,获得富
的超干重整,获得富 产物。装置示意图及反应原理如下。
产物。装置示意图及反应原理如下。 ,先通
,先通 和
和 混合气,分离水蒸气;再通惰性气体,获得富
混合气,分离水蒸气;再通惰性气体,获得富 产物。各催化剂表面发生的反应为:
产物。各催化剂表面发生的反应为:
① 表面:
表面: (反应①)、
(反应①)、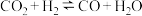 (反应②)
(反应②)
② 表面:
表面: (反应③)、
(反应③)、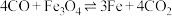 (反应④)
(反应④)
③ 表面:
表面: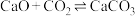 (反应⑤)
(反应⑤)
请回答:
(1)已知反应①的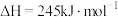 且
且 的燃烧热为
的燃烧热为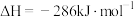 ,则
,则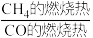
_______ 2(选填“>”“<”或“=”)。
(2) 催化下,研究单独使用
催化下,研究单独使用 对反应②的影响:
对反应②的影响: 。
。
①该反应的反应速率与浓度关系可表示为: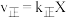 、
、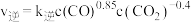 ,其中
,其中 、
、 为速率常数。则
为速率常数。则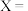
_______ (用含各物质的浓度的表达式表示)。
②某温度下该反应的平衡常数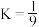 ,将等物质的量的
,将等物质的量的 和
和 通入含
通入含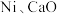 的反应器中,平衡后
的反应器中,平衡后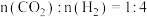 ,则
,则 的转化率为
的转化率为_______  (结果保留一位小数)。
(结果保留一位小数)。
(3)下列说法正确的是_______。
(4)一般情况下,催化剂并不能提高产物的平衡产率。但在该设计中,CO的平衡产率明显高于反应①单独进行时的 平衡产率,原因是
平衡产率,原因是_______ 。
 的超干重整,获得富
的超干重整,获得富 产物。装置示意图及反应原理如下。
产物。装置示意图及反应原理如下。
 ,先通
,先通 和
和 混合气,分离水蒸气;再通惰性气体,获得富
混合气,分离水蒸气;再通惰性气体,获得富 产物。各催化剂表面发生的反应为:
产物。各催化剂表面发生的反应为:①
 表面:
表面: (反应①)、
(反应①)、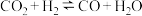 (反应②)
(反应②)②
 表面:
表面: (反应③)、
(反应③)、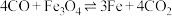 (反应④)
(反应④)③
 表面:
表面: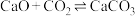 (反应⑤)
(反应⑤)请回答:
(1)已知反应①的
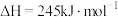 且
且 的燃烧热为
的燃烧热为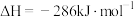 ,则
,则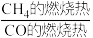
(2)
 催化下,研究单独使用
催化下,研究单独使用 对反应②的影响:
对反应②的影响: 。
。①该反应的反应速率与浓度关系可表示为:
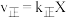 、
、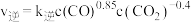 ,其中
,其中 、
、 为速率常数。则
为速率常数。则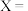
②某温度下该反应的平衡常数
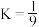 ,将等物质的量的
,将等物质的量的 和
和 通入含
通入含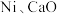 的反应器中,平衡后
的反应器中,平衡后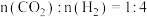 ,则
,则 的转化率为
的转化率为 (结果保留一位小数)。
(结果保留一位小数)。(3)下列说法正确的是_______。
A.获得等量 ,该技术的能耗小于单独用反应①的能耗 ,该技术的能耗小于单独用反应①的能耗 |
B.原料气中 与 与 的物质的量之比必须控制为 的物质的量之比必须控制为 |
C.该技术利用 暂存了 暂存了 ,利用 ,利用 暂存了还原性 暂存了还原性 |
D.须严格控制温度,防止 吸收水蒸气变成 吸收水蒸气变成 |
 平衡产率,原因是
平衡产率,原因是
您最近一年使用:0次
2 . 杭州第19届亚运会主火炬首次使用甲醇作燃料。已知:
I.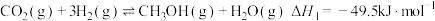
Ⅱ.
Ⅲ.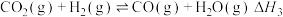
回答下列问题:
(1)
______  ,反应Ⅱ自发进行的条件是
,反应Ⅱ自发进行的条件是______ 。
(2)一定温度下,在恒容密闭容器中充入 和
和 只发生反应I。下列叙述正确的是______(填标号)。
只发生反应I。下列叙述正确的是______(填标号)。
(3)科学家对反应Ⅱ机理进行计算模拟,反应过程中能量变化如图所示。______ 步反应,总反应的最大能垒是______  。催化剂主要降低第
。催化剂主要降低第______ 步能垒。
(4)一定温度下,在甲、乙两个体积相同的反应容器中分别充入 和
和 ,发生反应
,发生反应 和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得
和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得 平得转化率与压强关系如图所示(已知:
平得转化率与压强关系如图所示(已知: 点
点 选择性为
选择性为 )。
)。 平衡转化率增大的原因是
平衡转化率增大的原因是______ 。采用水分子膜分离技术的是______ (填“甲”或“乙”)。
②该温度下, 点对应的反应Ⅲ平衡常数
点对应的反应Ⅲ平衡常数
______ (结果保留两位有效数字)。提示:用气体分压计算的平衡常数为压强平衡常数 ,气体分压
,气体分压 总压
总压 气体物质的量分数;
气体物质的量分数; 的选择性
的选择性 。
。
I.
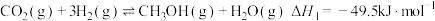
Ⅱ.

Ⅲ.
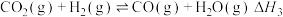
回答下列问题:
(1)

 ,反应Ⅱ自发进行的条件是
,反应Ⅱ自发进行的条件是(2)一定温度下,在恒容密闭容器中充入
 和
和 只发生反应I。下列叙述正确的是______(填标号)。
只发生反应I。下列叙述正确的是______(填标号)。A.达到平衡时最多生成 |
B. 体积分数不变时达到平衡状态 体积分数不变时达到平衡状态 |
C.平衡后再充入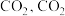 平衡转化率增大 平衡转化率增大 |
| D.升温,反应速䆥增大,平衡常数减小 |
(3)科学家对反应Ⅱ机理进行计算模拟,反应过程中能量变化如图所示。

 。催化剂主要降低第
。催化剂主要降低第(4)一定温度下,在甲、乙两个体积相同的反应容器中分别充入
 和
和 ,发生反应
,发生反应 和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得
和Ⅲ,其中一个容器使用水分子膜分离技术。实验测得 平得转化率与压强关系如图所示(已知:
平得转化率与压强关系如图所示(已知: 点
点 选择性为
选择性为 )。
)。
 平衡转化率增大的原因是
平衡转化率增大的原因是②该温度下,
 点对应的反应Ⅲ平衡常数
点对应的反应Ⅲ平衡常数
 ,气体分压
,气体分压 总压
总压 气体物质的量分数;
气体物质的量分数; 的选择性
的选择性 。
。
您最近一年使用:0次
名校
3 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ:

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(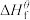 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: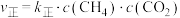 、
、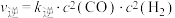 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
______  ,升高温度
,升高温度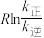 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,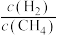 的值
的值______ (填“增大”“减小”或“不变”)。
(5)在101kPa时,工业上按投料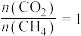 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
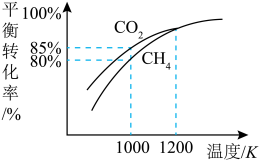
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:


回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
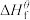 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
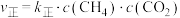 、
、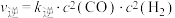 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
 ,升高温度
,升高温度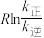 的值
的值
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为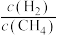 的值
的值(5)在101kPa时,工业上按投料
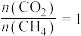 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2024-06-02更新
|
206次组卷
|
3卷引用:2024届山东省菏泽市高三下学期二模化学试题
名校
4 . 在推进碳达峰、碳中和的大背景下,可以通过多种手段实现 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:
(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:

反应Ⅱ:

①已知: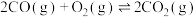
 ,则反应
,则反应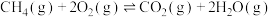 的
的
______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
②反应Ⅰ的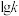 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为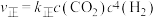 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。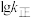 曲线的是
曲线的是______ (填“MH”或“NG”);反应Ⅰ的 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为______ (用含 、
、 的代数式表示)。
的代数式表示)。
③向某恒压密闭容器中充入5 mol CO2、和20mol 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量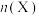 与温度T的关系如图2所示。
与温度T的关系如图2所示。______ (填含碳物质的分子式)的物质的量与温度的关系变化曲线;800K时,若平衡时容器内总压为p,图2中缺少的含碳物质平衡时为1.0 mol,则反应Ⅱ的压强平衡常数
_____ (结果保留两位有效数字, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①
 kJ⋅mol
kJ⋅mol
②
 kJ⋅mol
kJ⋅mol
控制压强为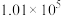 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为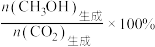 ]。
]。 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是____________ 。
(3)金红石型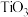 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。______ 中心(填字母)。
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为______ g·cm (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 的减排和资源化利用。请回答下列问题:
的减排和资源化利用。请回答下列问题:(1)科学家设想,二氧化碳加氢还原转化为推进剂甲烷,以实现星际旅行的愿望。其中涉及的主要反应如下:
反应Ⅰ:


反应Ⅱ:


①已知:
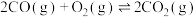
 ,则反应
,则反应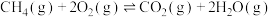 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。②反应Ⅰ的
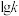 与温度的关系如图1所示。已知反应Ⅰ的速率方程为
与温度的关系如图1所示。已知反应Ⅰ的速率方程为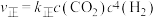 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。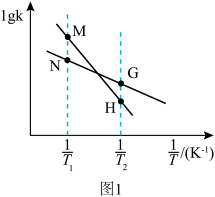
 曲线的是
曲线的是 (浓度平衡常数)与速率常数之间的关系为
(浓度平衡常数)与速率常数之间的关系为 、
、 的代数式表示)。
的代数式表示)。③向某恒压密闭容器中充入5 mol CO2、和20mol
 、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量
、和在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,平衡时两种含碳物质的物质的量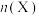 与温度T的关系如图2所示。
与温度T的关系如图2所示。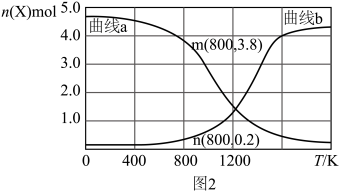

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(2)二氧化碳加氢制甲醇发生的主要化学反应如下:
①

 kJ⋅mol
kJ⋅mol
②

 kJ⋅mol
kJ⋅mol
控制压强为
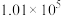 Pa、
Pa、 ,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对
,其他条件相同时,在密闭容器中发生上述反应①、②,反应温度对 的平衡转化率及
的平衡转化率及 的平衡选择性的影响如图3、4所示[
的平衡选择性的影响如图3、4所示[ 的选择性可表示为
的选择性可表示为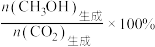 ]。
]。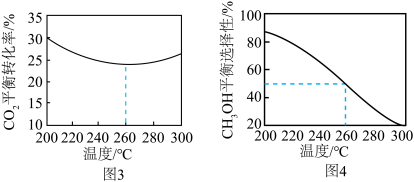
 的平衡转化率随温度升高而降低的原因是
的平衡转化率随温度升高而降低的原因是(3)金红石型
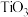 ,可用于
,可用于 催化氢化
催化氢化 ,其立方晶胞结构如图所示,设阿伏加德罗常数的值为
,其立方晶胞结构如图所示,设阿伏加德罗常数的值为 。
。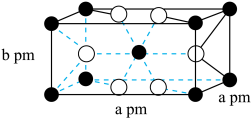
A.三角形 B.四面体 C.六面体 D.八面体
②该晶体的密度为
 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
5 . 2023年杭州亚运会主火炬创新使用了“零碳”甲醇作为燃料,所谓“零碳”,是指每合成1吨该甲醇可以消耗约1.375吨的二氧化碳,实现了二氧化碳的资源化利用、废碳再生。回答下列问题:
(1) 合成甲醇的工艺分两类:
合成甲醇的工艺分两类:
①直接法原理为:
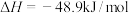
利于该反应自发进行的条件为___________ (填“高温”、“低温”或“任意温度”)。
②间接法合成原理如下:
Ⅰ.
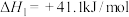
Ⅱ.

则
___________ 。该法的决速步骤为反应Ⅰ,则下列示意图中能体现上述反应反应进程与能量变化的是___________ 。___________ 。
(2)一定温度下,利用直接法合成甲醇,将二氧化碳和氢气按物质的量之比 混合并在恒定压强为44MPa条件下进行反应,达平衡时
混合并在恒定压强为44MPa条件下进行反应,达平衡时 的转化率为90%,则平衡时
的转化率为90%,则平衡时 的分压为
的分压为___________ ,该反应的分压平衡常数
___________  。
。
(3)直接甲醇燃料电池是指直接使用甲醇为电极活性物质的燃料电池,写出该电池在酸性条件下的负极反应方程式___________ 。
(4)目前有多种用于工业捕集 的方法,其中一种为以
的方法,其中一种为以 溶液吸收,若某工厂的
溶液吸收,若某工厂的 吸收液吸收一定量
吸收液吸收一定量 后测得溶液中
后测得溶液中 ,则该溶液的
,则该溶液的
___________ (已知该温度下碳酸的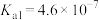 ,
,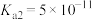 )。
)。
(1)
 合成甲醇的工艺分两类:
合成甲醇的工艺分两类:①直接法原理为:

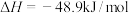
利于该反应自发进行的条件为
②间接法合成原理如下:
Ⅰ.

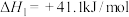
Ⅱ.


则

A. B.
B.
C. D.
D.

(2)一定温度下,利用直接法合成甲醇,将二氧化碳和氢气按物质的量之比
 混合并在恒定压强为44MPa条件下进行反应,达平衡时
混合并在恒定压强为44MPa条件下进行反应,达平衡时 的转化率为90%,则平衡时
的转化率为90%,则平衡时 的分压为
的分压为
 。
。(3)直接甲醇燃料电池是指直接使用甲醇为电极活性物质的燃料电池,写出该电池在酸性条件下的负极反应方程式
(4)目前有多种用于工业捕集
 的方法,其中一种为以
的方法,其中一种为以 溶液吸收,若某工厂的
溶液吸收,若某工厂的 吸收液吸收一定量
吸收液吸收一定量 后测得溶液中
后测得溶液中 ,则该溶液的
,则该溶液的
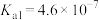 ,
,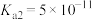 )。
)。
您最近一年使用:0次
解题方法
6 .  汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。
(1)已知在25℃, 时:
时:
反应ⅰ: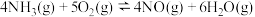

反应ⅱ: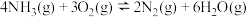
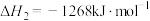
反应ⅲ:

________ 
(2)当 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为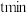 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示: 与
与 的物质的量之比为
的物质的量之比为________ 。
②若曲线a中 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为________  。
。
③在800℃~1100℃时,催化剂活性较稳定。则 脱除的最佳温度为
脱除的最佳温度为________ ℃, 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是________ 。
④940℃时,反应ⅲ的平衡常数
________ (用物质的量分数代替浓度,列计算式)。
⑤若其它条件不变,提高催化剂的活性,940℃时 的脱除率
的脱除率________ (选填“增大”“减小”或“不变”)。
(3)一定比例的 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示: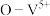 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)
①该反应的催化剂为________ 。
② 转化为
转化为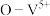 过程中
过程中 与
与 的物质的量比为
的物质的量比为________ 。
③ 转化为
转化为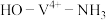 ,
, 键角增大的原因是
键角增大的原因是________ 。
 汽车尾气处理系统的原理是利用
汽车尾气处理系统的原理是利用 脱除
脱除 并转化为
并转化为 。
。(1)已知在25℃,
 时:
时:反应ⅰ:
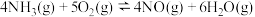

反应ⅱ:
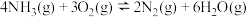
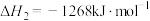
反应ⅲ:



(2)当
 与
与 的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为
的物质的量之比按1:3、3:1、4:1分别以相同流速通过催化剂,通过时间均为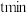 ,
, 的脱除率随温度变化的曲线如下图所示:
的脱除率随温度变化的曲线如下图所示:
 与
与 的物质的量之比为
的物质的量之比为②若曲线a中
 的起始浓度为
的起始浓度为 ,则在900℃时
,则在900℃时 的脱除速率为
的脱除速率为 。
。③在800℃~1100℃时,催化剂活性较稳定。则
 脱除的最佳温度为
脱除的最佳温度为 的脱除率在最佳温度之前逐渐增大的原因是
的脱除率在最佳温度之前逐渐增大的原因是④940℃时,反应ⅲ的平衡常数

⑤若其它条件不变,提高催化剂的活性,940℃时
 的脱除率
的脱除率(3)一定比例的
 和
和 也能很好的脱除
也能很好的脱除 ,某催化反应机理如下图所示:
,某催化反应机理如下图所示:
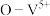 表示V化合价为
表示V化合价为 价,其它相似)
价,其它相似)①该反应的催化剂为
②
 转化为
转化为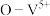 过程中
过程中 与
与 的物质的量比为
的物质的量比为③
 转化为
转化为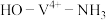 ,
, 键角增大的原因是
键角增大的原因是
您最近一年使用:0次
解题方法
7 . 利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.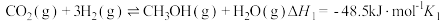
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。


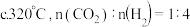

(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为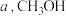 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数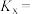
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为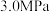 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气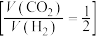 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为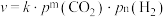 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,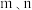 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则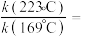
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
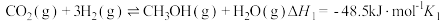
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。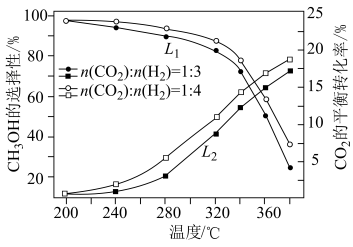
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是

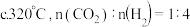

(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为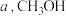 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数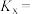
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
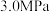 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气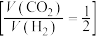 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
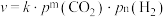 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,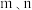 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则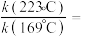
您最近一年使用:0次
8 . 甲烷蒸汽重整是制氢的主要途径,涉及反应如下:
反应Ⅰ:

反应Ⅱ:
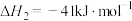
回答下列问题:
(1)标准摩尔生成焓( )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的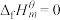 。根据下表数据计算a=
。根据下表数据计算a=________ 。
(2)向恒容密闭容器中按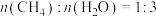 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。________ 。
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是________ 。
③600℃时, 的平衡转化率为
的平衡转化率为________ (保留两位有效数字),反应Ⅱ的
________ 。
(3)镍基复合催化剂可作为 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。
①在催化剂(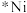 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。
a.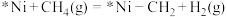
b.________
c.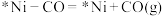
d.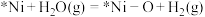
e.
补充b反应的方程式:________ 。
②镍基复合催化剂可吸收部分 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按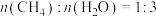 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
________ (用含 、p的表达式表示)。
、p的表达式表示)。
反应Ⅰ:


反应Ⅱ:

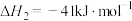
回答下列问题:
(1)标准摩尔生成焓(
 )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的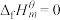 。根据下表数据计算a=
。根据下表数据计算a=物质 |
|
|
|
| -74.8 | -110.5 | -241.8 |
(2)向恒容密闭容器中按
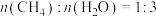 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。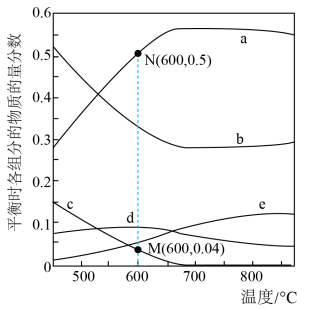
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是
③600℃时,
 的平衡转化率为
的平衡转化率为
(3)镍基复合催化剂可作为
 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。①在催化剂(
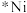 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。a.
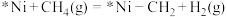
b.________
c.
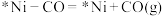
d.
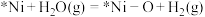
e.

补充b反应的方程式:
②镍基复合催化剂可吸收部分
 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按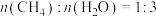 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
 、p的表达式表示)。
、p的表达式表示)。
您最近一年使用:0次
2024-05-28更新
|
190次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
9 . 绿色甲醇降碳效应显著,是实现“碳中和”目标的重要举措之一,2024年伊始,绿色甲醇项目被新纳入《产业结构调整指导目录》鼓励类,其推广和应用将迎来快速增长.绿色甲醇合成工艺包含二氧化碳捕集、甲醇合成等几个单元。
(1)二氧化碳捕集
目前有多种用于工业捕集 的方法,一种模拟脱除工业尾气中
的方法,一种模拟脱除工业尾气中 的示意图如图1所示:
的示意图如图1所示:
_________ .某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的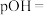
________ (该温度下 的
的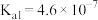 ,
,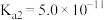 ,
,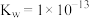 )
)
(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为 .
.
①向某一密闭容器中充入 和
和 ,在恒温恒压条件下发生反应,下列说法正确的是
,在恒温恒压条件下发生反应,下列说法正确的是_____________ (填选项标号);
A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,
D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入 和
和 发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率).
发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率)._________ ;二氧化碳加氢制甲醇的速率方程可表示为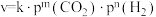 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比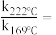
______ ;
③一定温度下,将体积分数为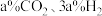 的进料气(含杂质气体),以
的进料气(含杂质气体),以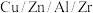 纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,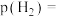
______ 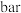 (用含a的代数式表示),该反应的平衡常数
(用含a的代数式表示),该反应的平衡常数
________  (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
④反应 一般认为经过以下步骤:
一般认为经过以下步骤:
反应1: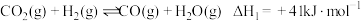
反应2:
若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图_______ ; 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为
的电极反应方程式为_____________ 。
(1)二氧化碳捕集
目前有多种用于工业捕集
 的方法,一种模拟脱除工业尾气中
的方法,一种模拟脱除工业尾气中 的示意图如图1所示:
的示意图如图1所示: 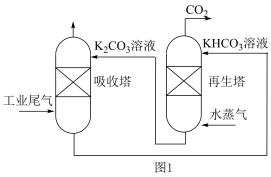
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的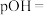
 的
的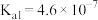 ,
,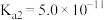 ,
,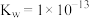 )
)(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为
 .
.①向某一密闭容器中充入
 和
和 ,在恒温恒压条件下发生反应,下列说法正确的是
,在恒温恒压条件下发生反应,下列说法正确的是A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,

D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入
 和
和 发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率).
发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率). 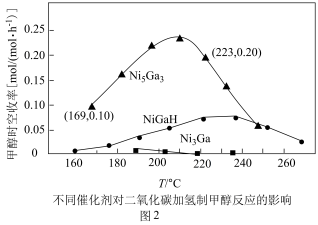
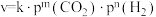 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用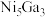 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数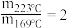 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比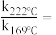
③一定温度下,将体积分数为
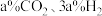 的进料气(含杂质气体),以
的进料气(含杂质气体),以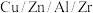 纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,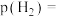
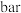 (用含a的代数式表示),该反应的平衡常数
(用含a的代数式表示),该反应的平衡常数
 (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);④反应
 一般认为经过以下步骤:
一般认为经过以下步骤:反应1:
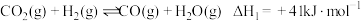
反应2:

若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图
 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为
的电极反应方程式为
您最近一年使用:0次
2024-05-28更新
|
107次组卷
|
2卷引用:河北省衡水市2024届高三下学期高考预测卷化学试题
解题方法
10 . 研究氮氧化物 (NOₓ)的还原处理方法是环保领域的主要方向之一。回答下列问题:
 .用H2还原NO的反应为
.用H2还原NO的反应为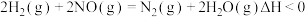

(1)该反应的正反应速率方程可表示为 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。
___________ ,
___________ 。
(2)研究表明上述反应历程分两步基元反应:
i. ;
;
ii.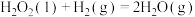 。
。
根据 (1)所给信息判断,H 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应___________ (填“ i”或“ii” ) 决定。
(3)将一定量的H 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是___________ 。
a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:
反应i. ;
;
反应ii. 。
。
反应过程中各物质相对能量如图 2 (TS表示过渡态): 的热化学方程式为
的热化学方程式为___________ 。
将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。___________ (填“高温”或者“低温”)。
(6)实验过程中,高于340℃后N O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是___________ 。
(7)450℃时, 该时间段内NO的脱除率=___________ (保留2位有效数字, NO的脱除率
 .用H2还原NO的反应为
.用H2还原NO的反应为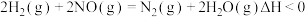

(1)该反应的正反应速率方程可表示为
 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。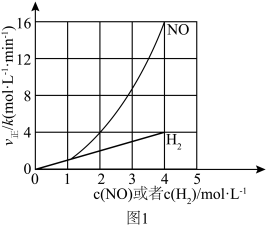


(2)研究表明上述反应历程分两步基元反应:
i.
 ;
;ii.
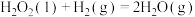 。
。根据 (1)所给信息判断,H
 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应(3)将一定量的H
 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:反应i.
 ;
;反应ii.
 。
。反应过程中各物质相对能量如图 2 (TS表示过渡态):
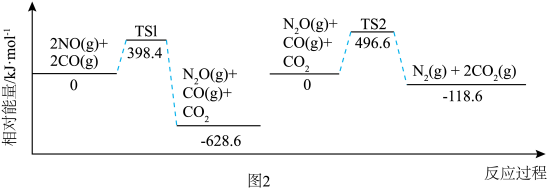
 的热化学方程式为
的热化学方程式为将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。
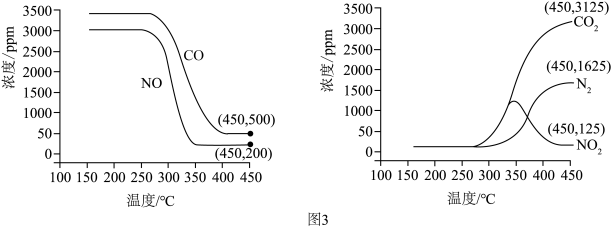
(6)实验过程中,高于340℃后N
 O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是(7)450℃时, 该时间段内NO的脱除率=

您最近一年使用:0次