名校
解题方法
1 . 二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中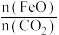 =6,则FexOy的化学式为
=6,则FexOy的化学式为___________ 。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为___________ 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
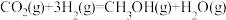

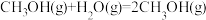
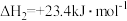
则
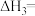
___________  。
。
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是___________ (填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。
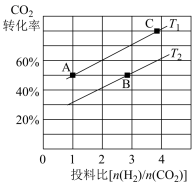
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率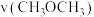 =
=___________ ;KA、KB、KC三者之间的大小关系为___________ 。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c( )
)___________ c( )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=___________ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中
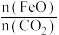 =6,则FexOy的化学式为
=6,则FexOy的化学式为②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为
(2)工业上用CO2和H2反应合成二甲醚。已知:
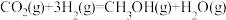

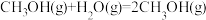
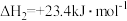
则

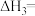
 。
。①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的
 值变小
值变小②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率
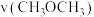 =
=(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(
 )
) )(填“>”、“<”或“=”);反应
)(填“>”、“<”或“=”);反应 +
+ +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2016-12-09更新
|
685次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题
名校
解题方法
2 . 已知CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206kJ / mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H= +247kJ / mol
C—H键的键能约为413 kJ / mol, O—H键的键能约为463 kJ / mol,H—H键的键能约为436 kJ / mol,则CO2中C=O键的键能约为
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H= +247kJ / mol
C—H键的键能约为413 kJ / mol, O—H键的键能约为463 kJ / mol,H—H键的键能约为436 kJ / mol,则CO2中C=O键的键能约为
| A.797.5 kJ / mol | B.900.5 kJ / mol |
| C.962.5 kJ / mol | D.1595 kJ / mol |
您最近一年使用:0次
2016-12-09更新
|
336次组卷
|
8卷引用:2015届重庆市南开中学高三12月月考理综化学试卷
3 . CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、4mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为___________ 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
求反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的 △H=
2CO(g)+2H2(g) 的 △H=___________ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4 CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,

请回答下列问题:
①250~300℃时,温度升高而乙酸的生成速率降低的原因是___________ 。
②为提高上述反应CH4的转化率,可采取的措施有___________ (写2种)。
(3)Li4SiO4可用于吸收、释放CO2,原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件):___________ 。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在___________ 范围内(填字母序号)。
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为___________ 极。
③放电时,内电路中Na+的移动方向为___________ (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx = 2Na+ xS(3<x<5),则阳极的电极反应式为___________ 。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、4mol CH4,发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:| 物 质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol·L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
求反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) 的 △H=
2CO(g)+2H2(g) 的 △H=(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4
 CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
请回答下列问题:
①250~300℃时,温度升高而乙酸的生成速率降低的原因是
②为提高上述反应CH4的转化率,可采取的措施有
(3)Li4SiO4可用于吸收、释放CO2,原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件):
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为
③放电时,内电路中Na+的移动方向为
④充电时,总反应为Na2Sx = 2Na+ xS(3<x<5),则阳极的电极反应式为
您最近一年使用:0次
9-10高三·湖北·阶段练习
名校
4 . 一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g) +2H2O(g) △H1="-" 574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—1160kJ·mol-1
下到选项正确的是 ( )
①CH4(g)+4NO2(g)=4NO(g)+CO2(g) +2H2O(g) △H1="-" 574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=—1160kJ·mol-1
下到选项正确的是 ( )
| A.CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H="-" 867kJ·mol-1 |
| B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1)的反应热为△H3,则△H3>△H1 |
| C.若用0.2molCH4还原NO2至N2,则反应中放出的热量一定为173.4kJ |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol |
您最近一年使用:0次
2016-12-09更新
|
371次组卷
|
3卷引用:重庆市第十八中学2016-2017学年高一下学期期中考试化学试题
重庆市第十八中学2016-2017学年高一下学期期中考试化学试题(已下线)2011届湖北省部分重点中学高三第二次联考理综)化学部分河南省南阳市第一中学2016-2017学年高二下学期第二次月考(5月)化学试题



