1 . 工业上常用 和
和 为原料合成
为原料合成 ,过程中发生如下两个反应:
,过程中发生如下两个反应:
反应Ⅰ: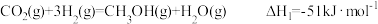
反应Ⅱ: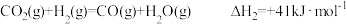
已知:几种化学键的键能如下表所示:
则“C≡O”的键能(kJ/mol)是
 和
和 为原料合成
为原料合成 ,过程中发生如下两个反应:
,过程中发生如下两个反应:反应Ⅰ:
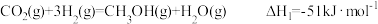
反应Ⅱ:
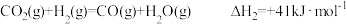
已知:几种化学键的键能如下表所示:
| 化学键 | C-H | C-O | H-O | H-H |
| 键能/kJ/mol | 406 | 351 | 465 | 436 |
| A.1070 | B.1067 | C.1162 | D.1152 |
您最近一年使用:0次
2021-11-11更新
|
221次组卷
|
2卷引用:重庆市2021-2022学年高三上学期第三次质量检测化学试题
9-10高二·山东·假期作业
名校
2 . 已知: ;
;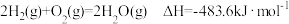 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
 ;
;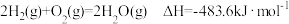 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为| A.1∶1 | B.1∶2 | C.2∶3 | D.3∶2 |
您最近一年使用:0次
2021-10-26更新
|
958次组卷
|
37卷引用:重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题
重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题(已下线)2010年安丘中学高二暑期练习化学卷(三)(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(理)试卷(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2015-2016学年辽宁省实验中学分校高一下期中化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题云南省临沧市第一中学2017-2018学年高二上学期第二次月考理综化学试题河北省邱县第一中学2017-2018学年高二上学期第一次月考化学试题河北省馆陶县第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题宁夏石嘴山市第三中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题广东省广州市中山大学附属中学2018-2019学年高二上学期期中考试化学试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2018-2019学年高一下学期期末考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题浙江省湖州中学2019-2020学年高一下学期3月月考(普通班)化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)辽源市第五中学2019-2020学年高一下学期第二次月考化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题河南省新乡县高级中学2021-2022学年高二上学期第一次月考化学试题山东省淄博市高青县第一中学2021-2022学年高二10月月考化学试题云南省昆明市官渡区第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题
3 . 现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:_______
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知 11g 丙烷(C3H8)在 298K 和 101Kpa 条件下完全燃烧生成 CO2和液态水时放出的热量 为 555kJ,请写出丙烷燃烧热的热化学方程式:_______ ;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。 已知:
C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
则相同条件下,反应 C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______
(3)已知:H—H 键的键能为 436kJ/mol,H—N 键的键能为 391kJ/mol,根据化学方程式:N2+3H2⇌2NH3ΔH=-92.4kJ/mol。
①请计算出 N≡N 键的键能为_______ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入 1molN2和 3molH2,充 分反应后,恢复原温度时放出的热量_______ 92.4KJ(填大于或小于或等于),理由:_______ 。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:_______
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
①已知 11g 丙烷(C3H8)在 298K 和 101Kpa 条件下完全燃烧生成 CO2和液态水时放出的热量 为 555kJ,请写出丙烷燃烧热的热化学方程式:
②丙烷在一定条件下发生脱氢反应可以得到丙烯。 已知:
C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
则相同条件下,反应 C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
(3)已知:H—H 键的键能为 436kJ/mol,H—N 键的键能为 391kJ/mol,根据化学方程式:N2+3H2⇌2NH3ΔH=-92.4kJ/mol。
①请计算出 N≡N 键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入 1molN2和 3molH2,充 分反应后,恢复原温度时放出的热量
您最近一年使用:0次
2021-10-17更新
|
125次组卷
|
2卷引用:重庆市天星桥中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
4 . 碳酸钠晶体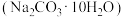 在干燥的空气中失水可得到
在干燥的空气中失水可得到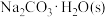 或
或 :
:
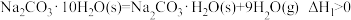

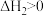
下列说法正确的是
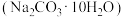 在干燥的空气中失水可得到
在干燥的空气中失水可得到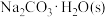 或
或 :
: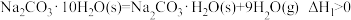

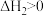
下列说法正确的是
A.向 中滴加几滴水,温度升高 中滴加几滴水,温度升高 |
| B.碳酸钠晶体的失水过程属于物理变化 |
C. 中 中 和 和 数目之比大于2 数目之比大于2 |
D.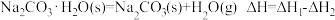 |
您最近一年使用:0次
5 . 通过以下反应可获得新型能源二甲醚(CH3OCH3),下列说法不正确的是
①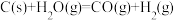
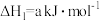
②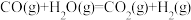

③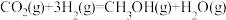
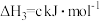
④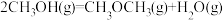
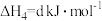 (d<0)
(d<0)
①
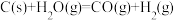
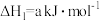
②
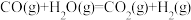

③
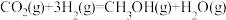
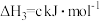
④
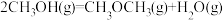
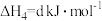 (d<0)
(d<0)| A.反应①、②为反应③提供原料气 |
| B.反应③也是CO2资源化利用的方法之一 |
C.反应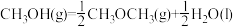 的 的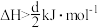 |
D.反应 的 的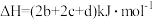 |
您最近一年使用:0次
2021-10-13更新
|
143次组卷
|
3卷引用:重庆市重庆实验外国语学校2021-2022学年高二上学期9月月考化学试题
6 . 设NA为阿伏加德罗常数的值。已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2=bkJ·mol-1
下列说法正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2=bkJ·mol-1
| 化学键 | C=O | O=O | C—H | O—H |
| 键能/(kJ·mol-1) | 798 | x | 413 | 463 |
A.表中x=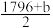 |
| B.H2O(g)=H2O(l) ΔH=(a-b)kJ·mol-1 |
C.当有4NA个C—H键断裂时,反应放出的热量一定为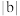 kJ kJ |
| D.a>b且甲烷燃烧热ΔH=bkJ·mol-1 |
您最近一年使用:0次
2021-10-09更新
|
144次组卷
|
3卷引用:重庆市西南大学附属中学校2021-2022学年高二上学期第一次定时检测化学试题
重庆市西南大学附属中学校2021-2022学年高二上学期第一次定时检测化学试题四川省眉山市仁寿第一中学北校区2021-2022学年高二上学期10月月考化学试题(已下线)必考点01 化学反应与能量-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)
名校
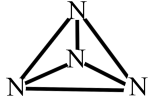
7 . 已知:①N4分子的结构式如图所示;②N—N键的键能为167kJ·mol-1,N≡N键的键能为942kJ·mol-1;③N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
 2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
| A.-1066.4kJ·mol-1 | B.+1066.4kJ·mol-1 |
| C.+697.6kJ·mol-1 | D.-697.6kJ·mol-1 |
您最近一年使用:0次
2021-09-10更新
|
560次组卷
|
4卷引用:重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题
重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题新疆阜康市第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题02 化学变化中的能量变化(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)
名校
8 . T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。由以上条件,回答下列问题:
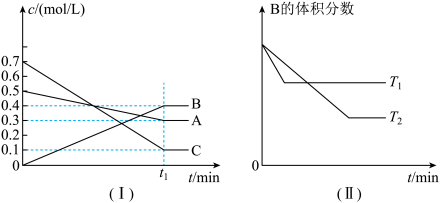
(1)该反应的化学方程式为___________
(2)该反应的平衡常数表达式为___________ 在T℃时,平衡常数的数值为(保留一位小数)___________ ;
(3)T1___________ T2(大于,小于,等于),该反应为___________ (填“吸热”或“放热”)反应
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有___________(填字母)
(5)已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) =CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=___________ kJ/mol

(1)该反应的化学方程式为
(2)该反应的平衡常数表达式为
(3)T1
(4)t1min后,改变下列某一条件,能使平衡向逆反应方向移动的有___________(填字母)
| A.保持其他条件不变,增大压强 | B.保持容器总体积不变,通入少量稀有气体 |
| C.保持其他条件不变,升高温度 | D.保持其他条件不变,降低温度 |
反应①:CO(g)+2H2(g) =CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
求反应②的ΔH2=
您最近一年使用:0次
9 . 甲醇是一种重要的化工原料,在生产中有着重要的应用。
(1)已知:①CH3OH(l) + 3/2O2(g)=CO2(g) + 2H2O(g) △H=-638.5 kJ·mol-1
②CO(g) + 1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
③H2O(l)=H2O(g) △H=+44.0 kJ·mol-1
则反应CH3OH(l) + O2(g)=CO(g) + 2H2O(l)的△H=______ kJ·mol-1。
(2)工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g) + 2H2(g) ⇌CH3OH(g) △H1
II.CO2(g) + 3H2(g) ⇌CH3OH(g) + H2O(g) △H2<0
III.CO2(g) + H2(g) ⇌CO(g) + H2O(g) △H3>0
①已知升高温度,反应Ⅰ的平衡常数K减小,则该反应的△H1__________ 0(填“>”或“<”)。
②对反应II而言,下列叙述中,能说明该反应达到化学反应平衡状态的是________ 。
a. 单位时间内消耗1 mol CO2的同时生成3 mol H2
b. 反应过程中c(CO2):c(CH3OH)=1:1
c. 恒温恒容时,混合气体的密度保持不变
d. 绝热恒容时,反应的平衡常数不再变化
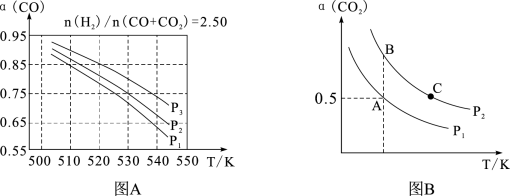
③上述反应体系中,当合成气的组成n(H2)/n(CO + CO2)=2.50时,体系中CO的平衡转化率(α)与温度和压强的关系如下图A所示。则图中压强由大到小的顺序为_____________ ,α(CO)随温度升高而减小的原因是___________________________ 。
(3)用甲醇、二氧化碳可以在一定条件下合成碳酸二甲酯(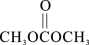 ,简称DMC),其反应的化学方程式为:2CH3OH(g) + CO2(g)
,简称DMC),其反应的化学方程式为:2CH3OH(g) + CO2(g)
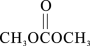 (g) + H2O(g)。在体积为2 L的恒容密闭容器中投入4 mol CH3OH(g) 和2 mol CO2(g) 合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图B所示。则:
(g) + H2O(g)。在体积为2 L的恒容密闭容器中投入4 mol CH3OH(g) 和2 mol CO2(g) 合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图B所示。则:
①A点时该反应的平衡常数K=__________ 。
②A、B、C三点的速率v (A)、v (B)、v (C)由快到慢的顺序为____________ 。
(1)已知:①CH3OH(l) + 3/2O2(g)=CO2(g) + 2H2O(g) △H=-638.5 kJ·mol-1
②CO(g) + 1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
③H2O(l)=H2O(g) △H=+44.0 kJ·mol-1
则反应CH3OH(l) + O2(g)=CO(g) + 2H2O(l)的△H=
(2)工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g) + 2H2(g) ⇌CH3OH(g) △H1
II.CO2(g) + 3H2(g) ⇌CH3OH(g) + H2O(g) △H2<0
III.CO2(g) + H2(g) ⇌CO(g) + H2O(g) △H3>0
①已知升高温度,反应Ⅰ的平衡常数K减小,则该反应的△H1
②对反应II而言,下列叙述中,能说明该反应达到化学反应平衡状态的是
a. 单位时间内消耗1 mol CO2的同时生成3 mol H2
b. 反应过程中c(CO2):c(CH3OH)=1:1
c. 恒温恒容时,混合气体的密度保持不变
d. 绝热恒容时,反应的平衡常数不再变化
③上述反应体系中,当合成气的组成n(H2)/n(CO + CO2)=2.50时,体系中CO的平衡转化率(α)与温度和压强的关系如下图A所示。则图中压强由大到小的顺序为

(3)用甲醇、二氧化碳可以在一定条件下合成碳酸二甲酯(
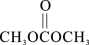 ,简称DMC),其反应的化学方程式为:2CH3OH(g) + CO2(g)
,简称DMC),其反应的化学方程式为:2CH3OH(g) + CO2(g)
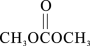 (g) + H2O(g)。在体积为2 L的恒容密闭容器中投入4 mol CH3OH(g) 和2 mol CO2(g) 合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图B所示。则:
(g) + H2O(g)。在体积为2 L的恒容密闭容器中投入4 mol CH3OH(g) 和2 mol CO2(g) 合成DMC,一定条件下CO2的平衡转化率(α)与温度、压强的变化关系如图B所示。则:①A点时该反应的平衡常数K=
②A、B、C三点的速率v (A)、v (B)、v (C)由快到慢的顺序为
您最近一年使用:0次
2021-07-20更新
|
1373次组卷
|
4卷引用:重庆西南大学附属中学校2020-2021学年高二下学期6月第四次月考化学试题
名校
解题方法
10 . 一碳化学的研究是从一氧化碳、二氧化碳出发,生产其他化工原料和产品的方法。在一定条件下,利用反应甲:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ∆H1,可以获得水及可再生能源甲醇。
CH3OH(g) + H2O(g) ∆H1,可以获得水及可再生能源甲醇。
请回答下列问题:
(1)①已知:O2(g) + 2H2(g) = 2H2O(g) ∆H2 = – 242 kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O(g) ∆H3 = – 630 kJ·mol-1
则∆H1 =___________ 。
②在恒温恒容密闭容器中充入a mol CO2和3a mol H2,下列能说明反应甲达到平衡状态的是_____ (填序号)。
A.体系的压强保持不变 B.CO2和H2的转化率相等
C.混合气体的密度保持不变 D.混合气体平均相对分子量保持不变
E.CO2、H2的物质的量浓度之比为1∶3,且不再随时间的变化而变化
(2)实验测得,在容器中可同时发生甲和乙两个反应。反应乙:CO2(g) + H2(g) CO(g) + H2O(g) ∆H4 = + 42.5 kJ·mol-1.在一定条件下,将1 mol CO2和3 mol H2充入到1 L恒容密闭容器中,测得反应容器中CO2平衡转化率(a),CH3OH选择性(b),CO选择性(c)随温度的关系如下图所示。
CO(g) + H2O(g) ∆H4 = + 42.5 kJ·mol-1.在一定条件下,将1 mol CO2和3 mol H2充入到1 L恒容密闭容器中,测得反应容器中CO2平衡转化率(a),CH3OH选择性(b),CO选择性(c)随温度的关系如下图所示。
[已知:CH3OH选择性=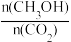 ×100%]
×100%]

③在T℃时,反应一段时间后,测得容器中n(CH3OH)∶n(CO2)∶n(CO) = 0.28∶0.70∶0.02,此时CO2转化率=___________ %。
④该容器中的反应达平衡后,下列措施中一定能提高平衡体系中CH3OH百分含量的是___________ 。
A.降低温度 B.增大CO2的浓度 C.增大压强 D.使用高效催化剂 E.在原料气中加入H2O(g)
⑤如图所示,240℃以上,随着温度升高,CO2的平衡转化率升高,而CH3OH的选择性降低,其原因可能是___________ 。
⑥250℃左右时,反应甲和乙达到平衡状态时,若CO2转化率为25%,CH3OH和CO选择性均为50%,则容器中c(H2) =___________ ,该温度下反应甲的平衡常数为___________ L2/mol2(列出计算式 )。
 CH3OH(g) + H2O(g) ∆H1,可以获得水及可再生能源甲醇。
CH3OH(g) + H2O(g) ∆H1,可以获得水及可再生能源甲醇。请回答下列问题:
(1)①已知:O2(g) + 2H2(g) = 2H2O(g) ∆H2 = – 242 kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O(g) ∆H3 = – 630 kJ·mol-1
则∆H1 =
②在恒温恒容密闭容器中充入a mol CO2和3a mol H2,下列能说明反应甲达到平衡状态的是
A.体系的压强保持不变 B.CO2和H2的转化率相等
C.混合气体的密度保持不变 D.混合气体平均相对分子量保持不变
E.CO2、H2的物质的量浓度之比为1∶3,且不再随时间的变化而变化
(2)实验测得,在容器中可同时发生甲和乙两个反应。反应乙:CO2(g) + H2(g)
 CO(g) + H2O(g) ∆H4 = + 42.5 kJ·mol-1.在一定条件下,将1 mol CO2和3 mol H2充入到1 L恒容密闭容器中,测得反应容器中CO2平衡转化率(a),CH3OH选择性(b),CO选择性(c)随温度的关系如下图所示。
CO(g) + H2O(g) ∆H4 = + 42.5 kJ·mol-1.在一定条件下,将1 mol CO2和3 mol H2充入到1 L恒容密闭容器中,测得反应容器中CO2平衡转化率(a),CH3OH选择性(b),CO选择性(c)随温度的关系如下图所示。[已知:CH3OH选择性=
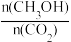 ×100%]
×100%]
③在T℃时,反应一段时间后,测得容器中n(CH3OH)∶n(CO2)∶n(CO) = 0.28∶0.70∶0.02,此时CO2转化率=
④该容器中的反应达平衡后,下列措施中一定能提高平衡体系中CH3OH百分含量的是
A.降低温度 B.增大CO2的浓度 C.增大压强 D.使用高效催化剂 E.在原料气中加入H2O(g)
⑤如图所示,240℃以上,随着温度升高,CO2的平衡转化率升高,而CH3OH的选择性降低,其原因可能是
⑥250℃左右时,反应甲和乙达到平衡状态时,若CO2转化率为25%,CH3OH和CO选择性均为50%,则容器中c(H2) =
您最近一年使用:0次



