2018高三·全国·专题练习
名校
1 . 研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为____________________________ 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1,N—H键的键能是391.55 kJ•mol−1,则1/2N2(g)+3/2H2(g) NH3(g) ΔH=
NH3(g) ΔH=_____________________ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) CO2(g) ΔH1=−393.5 kJ•mol−1
CO2(g) ΔH1=−393.5 kJ•mol−1
②2H2(g)+O2(g) 2H2O(l) ΔH2=−571.6 kJ•mol−1
2H2O(l) ΔH2=−571.6 kJ•mol−1
③2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
298 K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH=_____________________ 。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g) 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g) 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ•mol−1,H—H键的键能是436.0 kJ•mol−1,N—H键的键能是391.55 kJ•mol−1,则1/2N2(g)+3/2H2(g)
 NH3(g) ΔH=
NH3(g) ΔH=(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)
 CO2(g) ΔH1=−393.5 kJ•mol−1
CO2(g) ΔH1=−393.5 kJ•mol−1②2H2(g)+O2(g)
 2H2O(l) ΔH2=−571.6 kJ•mol−1
2H2O(l) ΔH2=−571.6 kJ•mol−1③2C2H2(g)+5O2(g)
 4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1
4CO2(g)+2H2O(l)ΔH3=−2599 kJ•mol−1298 K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH=
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)
 2Al2O3(s) ΔH1
2Al2O3(s) ΔH14Fe(s)+3O2(g)
 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2下面关于ΔH1、ΔH2的比较正确的是
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
您最近一年使用:0次
2018-10-22更新
|
249次组卷
|
5卷引用:重庆市南开中学2018-2019学年高二上学期第一次月考化学试题
重庆市南开中学2018-2019学年高二上学期第一次月考化学试题(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)(已下线)【南昌新东方】2019 进贤二中 高二上 第二次月考
名校
解题方法
2 . 镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、 GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________ 。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________ 。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=_____________ 。
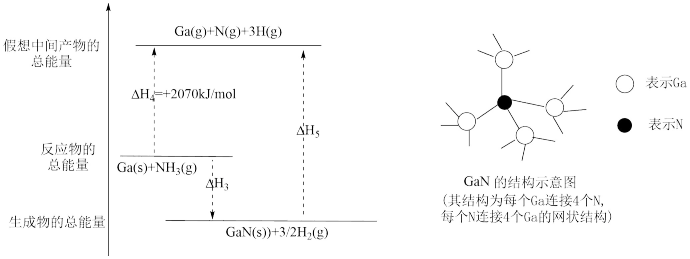
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____ molGa-N键,拆开lmolGa-N键所需能量为______ kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
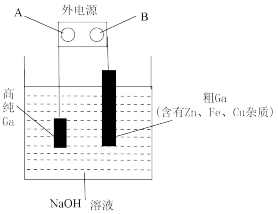
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____ 极,电解精炼镓时产生阳极泥的主要成分是___________ 。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________ 。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________ 。(η=生成目标产物消耗的电子数÷转移的电子总数)。
(1)请画出Ga的原子结构示意图
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+ NH3(g)=GaN(s)+3HCl(g) ∆H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g) ∆H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) ∆H3
由上述反应可知∆H3=

已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=
您最近一年使用:0次
3 . 一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的探明储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g) 2CO(g) ∆H1=akJ/mol
2CO(g) ∆H1=akJ/mol
II.CO(g)+H2O(g) H2(g)+CO2(g) △H2=bkJ/mol
H2(g)+CO2(g) △H2=bkJ/mol
III.C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3________ 。
(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g) H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:

①该反应的△H__ 0 (填“<”或“>”。)
②在某温度下,能判断该反应是否达到化学平衡状态的依据是________ 。
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为__________ 。
④在体积不变时,要增大该反应的正反应速率可采取的措施是_______ (写两条)。
⑤A点时该反应的平衡常数为________ (保留到小数点后两位)。
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为_______ 。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g)
 2CO(g) ∆H1=akJ/mol
2CO(g) ∆H1=akJ/mol II.CO(g)+H2O(g)
 H2(g)+CO2(g) △H2=bkJ/mol
H2(g)+CO2(g) △H2=bkJ/molIII.C(s)+H2O(g)
 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g)
 H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
①该反应的△H
②在某温度下,能判断该反应是否达到化学平衡状态的依据是
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为
④在体积不变时,要增大该反应的正反应速率可采取的措施是
⑤A点时该反应的平衡常数为
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为
您最近一年使用:0次
名校
解题方法
4 . 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式______________________________________ 。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________ 。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式
您最近一年使用:0次
解题方法
5 . 肼 是一种应用广泛的化工原料。工业上先合成氨气:
是一种应用广泛的化工原料。工业上先合成氨气: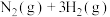

 ,再进一步制备肼。完成下列填空:
,再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同):
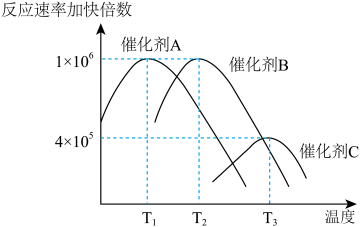
则生产中适宜选择的催化剂是______ (填“A”或“B”或“C”),理由是:______________ 。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)。
(3)肼可作为火箭燃料, 在
在 气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:
气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:__________________________________________ 。上述反应中,氧化剂是_____________ (写化学式),每1mol 参加反应,转移的电子是
参加反应,转移的电子是________ mol。
 是一种应用广泛的化工原料。工业上先合成氨气:
是一种应用广泛的化工原料。工业上先合成氨气: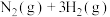

 ,再进一步制备肼。完成下列填空:
,再进一步制备肼。完成下列填空:(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同):

则生产中适宜选择的催化剂是
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)。
| 反应速率 | 平衡常数K | 氨的体积分数 |
变化情况 |
 在
在 气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:
气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式: 参加反应,转移的电子是
参加反应,转移的电子是
您最近一年使用:0次
2018-04-14更新
|
264次组卷
|
2卷引用: 重庆市2023-2024学年高三下学期2月月度质量检测化学试题
解题方法
6 . I.氢气是一种清洁能源,其来源可以是:
途径1.用太阳能分解水生成氢气 途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
已知:在25℃、101kPa时 2CO(g)+ O2(g) ===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。补全该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH =_________
(2)已知拆开与形成1mol化学键需要相同的能量,途径2中,拆开1mol H-H键需能量是ckJ、1molH-O键是bkJ、1mol C-H键是akJ,则拆开1mol CO(g)化学键需要能量是_______ kJ (用含字母的式子表示)
(3)CH4燃烧生成CO2和气态H2O的热化学方程式为__________
II.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。
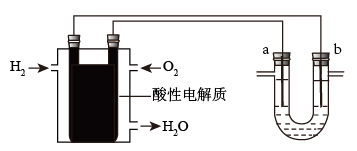
(4)燃料电池工作时,正极反应为:______________ 。
(5)U形管中装CuSO4溶液时,a、b两极均是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积比是:________ 。
(6)U形管中装饱和NaCl水溶液时,电解总反应的离子方程式是______________ 。
(7)用惰性电极电解M(NO3)x的水溶液,当阴极上增重m克时,在阳极上同时产生nL氧气(标准状况),从而可知M的相对原子质量是_________ 。(用含字母的式子表示)
途径1.用太阳能分解水生成氢气 途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
已知:在25℃、101kPa时 2CO(g)+ O2(g) ===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。补全该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH =
(2)已知拆开与形成1mol化学键需要相同的能量,途径2中,拆开1mol H-H键需能量是ckJ、1molH-O键是bkJ、1mol C-H键是akJ,则拆开1mol CO(g)化学键需要能量是
(3)CH4燃烧生成CO2和气态H2O的热化学方程式为
II.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。

(4)燃料电池工作时,正极反应为:
(5)U形管中装CuSO4溶液时,a、b两极均是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积比是:
(6)U形管中装饱和NaCl水溶液时,电解总反应的离子方程式是
(7)用惰性电极电解M(NO3)x的水溶液,当阴极上增重m克时,在阳极上同时产生nL氧气(标准状况),从而可知M的相对原子质量是
您最近一年使用:0次
名校
解题方法
7 . 氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) CO(g)+ 2H2 △H =+90kJ·mol-1
CO(g)+ 2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g) CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________ (填“A”或“B”),理由为_____________ 。T1℃时,体系的平衡压强与起始压强之比为_________________________ 。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______ (填“增大““减小”或“不变”),理由为____________ 。
②p1、p2、p3由大到小的顺序为___________________ 。
③测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________ 。
i.CH3OH(g)
 CO(g)+ 2H2 △H =+90kJ·mol-1
CO(g)+ 2H2 △H =+90kJ·mol-1 ii.CO(g)+H2O(g)
 CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1 (1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值
②p1、p2、p3由大到小的顺序为
③测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=
您最近一年使用:0次
名校
8 . N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g) CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确 的是

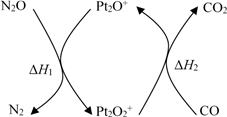
 CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法

| A.ΔH = ΔH1 + ΔH2 |
| B.ΔH = −226 kJ/mol |
| C.该反应正反应的活化能小于逆反应的活化能 |
| D.为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+ |
您最近一年使用:0次
2018-01-20更新
|
1285次组卷
|
25卷引用:重庆市西南大学附属中学校2021届第三次月考化学试题
重庆市西南大学附属中学校2021届第三次月考化学试题北京市丰台区2018届高三上学期期末考试化学试题北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题河北省张家口第一中学2019-2020学年高二9月月考化学试题辽宁省实验中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:综合检测(二)四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题北京市第十五中学2018-2019学年高三上学期期中考试化学试题四川省成都市第七中学2020届高三上学期入学考试化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第一次月考化学试题山东省实验中学2021届高三上学期第一次诊断考试化学试题湖南省娄底市第一中学2020-2021学年高二上学期期中考试化学(高考班)试题安徽师范大学附属中学2020-2021学年高二上学期期中考查化学试题广东省佛山市第一中学2020-2021学年高二上学期第一次段考化学(选考)试题福建省厦门市湖滨中学2021届高三上学期期中考试化学试题山东省济南市莱芜一中2021届高三1月份月考化学试题广西河池市九校2020-2021学年高二下学期第二次联考化学试题山东省栖霞市第一中学2021-2022学年高三上学期开学摸底考试化学试题北京朝阳市陈经纶中学2021-2022学年高三上学期10月月考化学试题北京市第二十二中学2021-2022学年高三上学期期中考试化学试题安徽省滁州市部分学校2021-2022学年高二下学期4月联考化学试题山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题山东省蓬莱第二中学2021-2022学年高三上学期第一次月考化学试题
9 . 丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________ 条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________ 。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______ (用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________ ,CO32-移向电池的___ 极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____ L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________ 。
途径I:CH3CH2CH3(g)
 CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1途径II :nCH3OH(g)
 CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=
(2)途径I制备丙烯,要提高丙烯的产率最好采用
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为
您最近一年使用:0次
10 . 已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、a kJ·mol-1和462kJ·mol-1,则a为
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、a kJ·mol-1和462kJ·mol-1,则a为
| A.496 | B.118 | C.350 | D.130 |
您最近一年使用:0次
2016-12-09更新
|
383次组卷
|
4卷引用:2014-2015学年重庆市主城区六校高二上期末联考化学试卷
2014-2015学年重庆市主城区六校高二上期末联考化学试卷福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题新疆阜康市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)2021年1月浙江高考化学试题变式题11-20



