1 . 爱动脑筋的重庆一中化学组张郭根老师幻想着,假如存在A-F六种物质在一定条件下能按如图所示能量循环图进行相互转换,则下列说法中错误的是( )
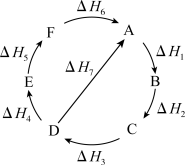

| A.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| B.ΔH7=ΔH1+ΔH2+ΔH3 |
| C.ΔH5=ΔH7-ΔH4-ΔH6 |
| D.│ΔH1+ΔH2+ΔH3│=│ΔH4+ΔH5+ΔH6│ |
您最近一年使用:0次
2020-10-21更新
|
431次组卷
|
4卷引用:重庆市第一中学2020-2021学年高二10月月考化学试题
名校
解题方法
2 . CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量___ (填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是____ (填序号)。
A.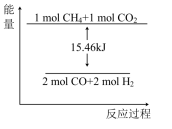 B.
B.  C.
C. 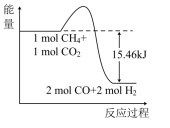 D.
D.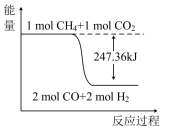
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为___ 。

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=____ 。
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是____ (填序号)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
您最近一年使用:0次
2020-10-12更新
|
645次组卷
|
11卷引用:重庆市南开中学2018-2019学年高二上学期第一次月考化学试题
重庆市南开中学2018-2019学年高二上学期第一次月考化学试题2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年天津市静海一中高二上9月调研化学试卷【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练江苏省南通西藏民族中学2020-2021学年高二上学期期中考试化学(选修)试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)选择性必修1(SJ)专题1第一单元易错疑难集训(二)广西浦北中学2021-2022学年高二上学期第一次月考化学试题
名校
3 . 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____________ 。
(2)已知: △H1=-890.3 kJ∙mol-1
△H1=-890.3 kJ∙mol-1
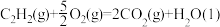 △H2=-1299.6 kJ∙mol-1
△H2=-1299.6 kJ∙mol-1
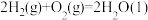 △H3=-571.6 kJ∙mol-1
△H3=-571.6 kJ∙mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=_______ kJ∙mol-1。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)的对数与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H ____________ 0(填“>”或“<”),CH4的平衡转化率为__________ %(保留3位有效数字)。上述平衡状态在某一时刻,若改变温度至T2℃,c(CH4)以0.01mol∙L-1∙s-1平均速率增多,经 后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1
后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_________ (填“>”或“<”)T2,t=_________ s。
②列式计算反应2CH4(g) C2H2(g)+3H2(g)在图中A℃时的平衡常数K=
C2H2(g)+3H2(g)在图中A℃时的平衡常数K=__________ (用平衡分压代替平衡浓度计算, )。
)。
③由图可知,甲烷裂解制乙炔时有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有________________ 。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为
(2)已知:
 △H1=-890.3 kJ∙mol-1
△H1=-890.3 kJ∙mol-1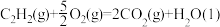 △H2=-1299.6 kJ∙mol-1
△H2=-1299.6 kJ∙mol-1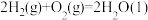 △H3=-571.6 kJ∙mol-1
△H3=-571.6 kJ∙mol-1则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)的对数与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H  后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1
后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1②列式计算反应2CH4(g)
 C2H2(g)+3H2(g)在图中A℃时的平衡常数K=
C2H2(g)+3H2(g)在图中A℃时的平衡常数K= )。
)。③由图可知,甲烷裂解制乙炔时有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
您最近一年使用:0次
2020-09-14更新
|
367次组卷
|
6卷引用:【全国百强校】重庆南开中学2019届高三下学期适应性考试理科综合化学试题
名校
解题方法
4 . 2019年国际非政府组织“全球计划”12月4日发布报告:CO2过量排放会引发温室效应,CO2资源化的高效利用是解决温室问题的有效途径。
(1)CO2可通过催化加氢合成甲醇(CH3OH),其相关反应在不同温度下的化学平衡常数如下表所示。
①判断反应III:ΔH_____ 0(填“>”、“<”或“=”);
②根据反应III的特点,有利于提高甲醇平衡产率的条件是______ ;
A高压高温 B低压高温 C高压低温 D低压低温
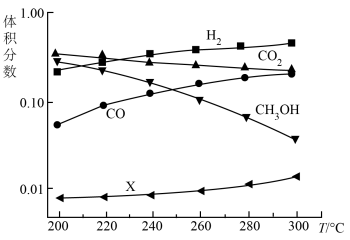
③5MPa时,往某密闭容器中充入H2和CO2发生反应,平衡体系中各组分的体积分数随温度的变化情况如图所示。由图可知,随温度的升高,CO2的体积分数逐渐减小,其原因为:_____________ ;
(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等反应过程如图。
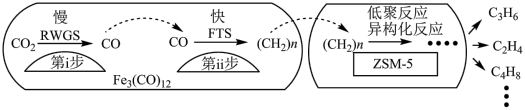
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_____ 助剂效果最好;
②下列说法正确的是____ :
a.第i步反应为:CO2+H2 CO+H2O
CO+H2O
b.第i步反应的活化能低于第ii步
c.加入助剂能提高单位时间内乙烯产量的原因是降低生成乙烯的反应所需要的活化能
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
(1)CO2可通过催化加氢合成甲醇(CH3OH),其相关反应在不同温度下的化学平衡常数如下表所示。
| 化学反应 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | |
I.H2(g+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | 1.00 | 1.50 | 2.50 |
II.2H2(g)+CO(g) CH3OH(g) CH3OH(g) | 2.00 | 0.5 | 0.25 |
III.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH CH3OH(g)+H2O(g) ΔH | |||
①判断反应III:ΔH
②根据反应III的特点,有利于提高甲醇平衡产率的条件是
A高压高温 B低压高温 C高压低温 D低压低温
③5MPa时,往某密闭容器中充入H2和CO2发生反应,平衡体系中各组分的体积分数随温度的变化情况如图所示。由图可知,随温度的升高,CO2的体积分数逐渐减小,其原因为:

(2)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②下列说法正确的是
a.第i步反应为:CO2+H2
 CO+H2O
CO+H2Ob.第i步反应的活化能低于第ii步
c.加入助剂能提高单位时间内乙烯产量的原因是降低生成乙烯的反应所需要的活化能
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
您最近一年使用:0次
5 . 研究化学反应时,既要关注物质变化, 又要关注能量变化。请回答以下问题.
(1)氢气在氧气中燃烧 ,破坏1mol H-H 键吸收Q1 kJ 的热量,破坏 1 mol O=O 键吸收Q2kJ 的热量, 形成 1 mol H—O 键释放Q3kJ 的热量,则下列关系式正确的是。_____ (填字母序号)
A 2Q1+Q2>4Q3 B Q1+Q 2<Q3
C 2Q 1+ Q 2<4Q3 D 2 Q1+Q 2=4Q3
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①2N2(g)+ CO2(g)+ 2H2O(g)= CH4(g)+ 4NO(g) ΔH1=akJ/mol
②CH4(g)+ 4NO2(g)= 4 NO(g)+ CO2(g) + 2 H2O(g) ΔH2 = b kJ/mol
③H2O(1)= H2O(g)ΔH3 =c kJ/mol
则CH4(g)+2NO2(g)=N2(g)+ CO2(g)+ 2H2O(1) ΔH=_______ kJ/mol (用含a、b、c的代数式表示)。
(3)红磷 P(s)和Cl2(g) 发生反应生成PCl3(g)和 PCl5(g), 反应过程中的热量关系如图所示(图中的ΔH表示生成 1mol 产物的数据)。
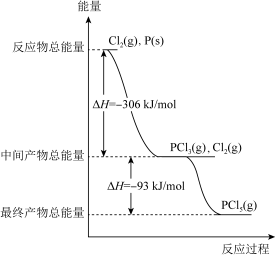
根据如图回答下列问题:
①写出P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式________ ;
②已知:常温时红磷比白磷稳定,比较下列反应中ΔH 的大小:ΔH1___ ΔH2(填“> ”、“< ”或“= ”)。
i.P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1< 0
ii.4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2< 0
(1)氢气在氧气中燃烧 ,破坏1mol H-H 键吸收Q1 kJ 的热量,破坏 1 mol O=O 键吸收Q2kJ 的热量, 形成 1 mol H—O 键释放Q3kJ 的热量,则下列关系式正确的是。
A 2Q1+Q2>4Q3 B Q1+Q 2<Q3
C 2Q 1+ Q 2<4Q3 D 2 Q1+Q 2=4Q3
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①2N2(g)+ CO2(g)+ 2H2O(g)= CH4(g)+ 4NO(g) ΔH1=akJ/mol
②CH4(g)+ 4NO2(g)= 4 NO(g)+ CO2(g) + 2 H2O(g) ΔH2 = b kJ/mol
③H2O(1)= H2O(g)ΔH3 =c kJ/mol
则CH4(g)+2NO2(g)=N2(g)+ CO2(g)+ 2H2O(1) ΔH=
(3)红磷 P(s)和Cl2(g) 发生反应生成PCl3(g)和 PCl5(g), 反应过程中的热量关系如图所示(图中的ΔH表示生成 1mol 产物的数据)。

根据如图回答下列问题:
①写出P(s)和Cl2(g)反应生成PCl5(g)的热化学方程式
②已知:常温时红磷比白磷稳定,比较下列反应中ΔH 的大小:ΔH1
i.P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1< 0
ii.4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2< 0
您最近一年使用:0次
2020-08-05更新
|
532次组卷
|
6卷引用:重庆市第一中学2019-2020学年高二下学期期末考试化学试题
重庆市第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题陕西省汉中市部分高中2020-2021学年高二上学期12月月考化学试题山西省山西师范大学实验学校2021-2022学年高二上学期第二次月考化学试题陕西省武功县普集高级中学2023-2024学年高二上学期10月月考化学试题
6 . 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )
O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )

 O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )
O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( ) 
| A.CO的燃烧热为283 kJ |
| B.如图所示为CO生成CO2的反应过程和能量的关系 |
| C.2Na2O2(s)+2CO2(s) =2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023 |
您最近一年使用:0次
2020-07-17更新
|
467次组卷
|
15卷引用:重庆市荣昌永荣中学校2021-2022学年高二上学期期中考试化学试题
重庆市荣昌永荣中学校2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷2015-2016学年贵州省思南中学高二上第一半月考化学试卷【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期中考试化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题四川省成都外国语学校2019-2020学年高一下学期期末考试化学(理)试题四川省广安市武胜烈面中学校2020-2021学年高二上学期10月月考化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题云南省普洱市景东县第一中学2021届高三上学期期末考试化学试题第24届(2010年)全国高中学生化学竞赛(湖北赛区)预赛试题湖南省长沙市第一中学2020-2021学年高二上学期入学考试化学试题(已下线)1.1.3 能源的充分利用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1) 内蒙古赤峰市第四中学分校2021-2022学年高二上学期期中考试化学试题 天津市实验中学2021-2022学年高三上学期第一次阶段考试化学试题 北京市育才学校2023-2024学年高二上学期10月月考化学试题
7 . 四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
②C(s)+ O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
下列说法正确的是
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
②C(s)+
 O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
O2(g)=CO(g)ΔH2=-110.45kJ·mol-1下列说法正确的是
| A.C的燃烧热是-110.45kJ·mol-1 |
| B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH1变大 |
C.反应①中的能量变化如图所示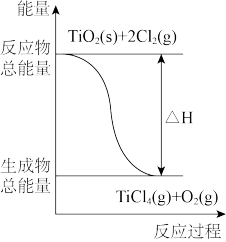 |
| D.反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)ΔH=-45.5kJ·mol-1 |
您最近一年使用:0次
2020-07-01更新
|
396次组卷
|
6卷引用:重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题
名校
解题方法
8 . 甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛,回答下列问题:
已知:Ⅰ.2CH2=CH2(g)+O2(g)⇌2 (g) ΔH1<0
(g) ΔH1<0
Ⅱ.CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(l) ΔH2
Ⅲ.2 (g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3______ (填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=________ kJ·mol-1。
(3)实验测得2CH2=CH2(g)+O2(g)⇌2 (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2( )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数________ (填“大于”“小于”或“等于”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=_________ ,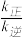 =
=___________ (保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是________ (填字母)。
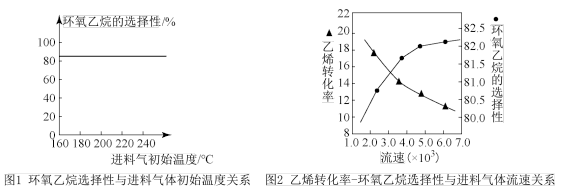
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水
(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。

a极上的电极反应式为_____________ ;若电路中转移0.1mol电子,则消耗标准状况下CH4的体积为_____________ L。
已知:Ⅰ.2CH2=CH2(g)+O2(g)⇌2
 (g) ΔH1<0
(g) ΔH1<0Ⅱ.CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(l) ΔH2
Ⅲ.2
 (g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=
(3)实验测得2CH2=CH2(g)+O2(g)⇌2
 (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2( )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=
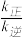 =
=(4)下列有关环氧乙烷制备的说法正确的是
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水

(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。

a极上的电极反应式为
您最近一年使用:0次
2020-05-15更新
|
254次组卷
|
3卷引用:重庆巴蜀中学高2020届高三下学期3月月月考理综化学试题
名校
解题方法
9 . 汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__ 。
②请写出CO和NO生成无污染气体的热化学方程式为__ 。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
①下列说法正确的是__ 。
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__ 。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
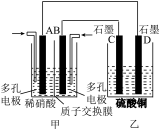
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__ (填化学式);A电极的电极反应式为__ 。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=
②请写出CO和NO生成无污染气体的热化学方程式为
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。| 时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

您最近一年使用:0次
名校
10 . 燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1,ΔH1=_________ 。
(2)针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
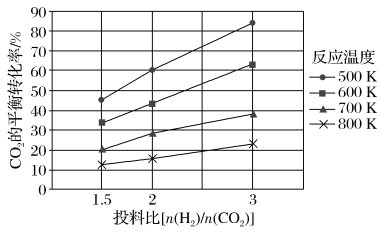
①ΔH1________ (填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会________ (填“增大”“减小”或“不变”,下同),平衡常数K会________ 。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是________________

②若在2 L恒容密闭容器中,将3mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________ 。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是_____ (填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(1)已知:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1,ΔH1=
(2)针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:

①ΔH1
②若其他条件不变,仅仅增大压强,则逆反应速率会
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)⇌2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是

②若在2 L恒容密闭容器中,将3mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是
A.CO B.SO2 C.N2 D.H2S E.CO2
您最近一年使用:0次
2020-04-30更新
|
93次组卷
|
2卷引用:重庆市重庆实验外国语学校2021-2022学年高二上学期9月月考化学试题



