1 . 在含有Fe3+、S2O 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
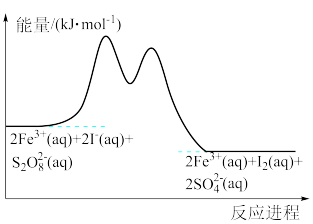
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)
下列关于该反应的说法错误的是
 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
(aq)+I2(aq)的分部机理如下,反应进程中的能量变化如图所示。
步骤①:2Fe3+(aq)+2I-(aq)=2Fe2+(aq)+I2(aq)
步骤②:S2O
 (aq)+2Fe2+(aq)=2SO
(aq)+2Fe2+(aq)=2SO (aq)+2Fe3+(aq)
(aq)+2Fe3+(aq)下列关于该反应的说法错误的是
| A.Fe3+是该反应的催化剂 |
| B.步骤②比步骤①速率快 |
| C.该反应为放热反应 |
| D.若不加Fe3+,则正反应的活化能比逆反应的大 |
您最近一年使用:0次
2021-06-15更新
|
609次组卷
|
5卷引用:重庆市缙云教育联盟2021-2022学年高三下学期3月质量检测化学试题
重庆市缙云教育联盟2021-2022学年高三下学期3月质量检测化学试题辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题
2 . 在 101 kPa、TK下,由指定单质(如 O2)生成 1mol 某种物质的焓变叫做该物质在TK 时的标准生成焓,用 ΔHf 表示。已知298K 时CO2 的ΔHf=-394 kJ/mol,C(金刚石)的燃烧热 ΔH =-395.9 kJ/mol。则298K时C(金刚石)的ΔH f 等于
| A.0 | B.+1.9 kJ/mol | C.-1.9 kJ/mol | D.无法确定 |
您最近一年使用:0次
名校
解题方法
3 . 如图是金属镁和卤素单质(X2)反应的相对能量变化的示意图。下列说法正确的是
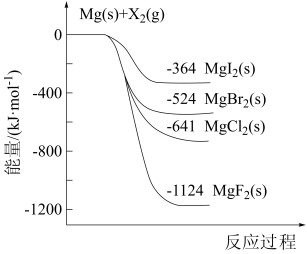

| A.由MgCl2制Mg是放热过程 |
| B.稳定性:Mgl2>MgBr2>MgCl2>MgF2 |
| C.1 mol不同的卤素单质(X2)的能量是相同的 |
| D.此温度下Cl2(g)置换Br2(g)的热化学方程式为MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=-117 kJ/mol |
您最近一年使用:0次
2021-03-13更新
|
448次组卷
|
6卷引用:重庆市巴蜀中学2021届高三高考适应性月考卷(七)化学试题
重庆市巴蜀中学2021届高三高考适应性月考卷(七)化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)宁夏六盘山高级中学2023-2024学年高二上学期第一次月考化学试题
4 . 电解饱和食盐水的能量关系如图所示(所有数据均在室温下测得):
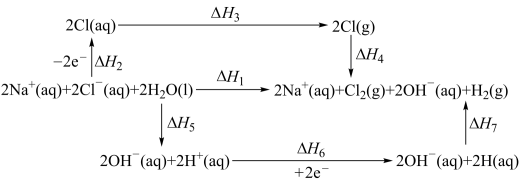
下列说法不正确的是

下列说法不正确的是
A. |
B.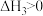 , ,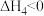 |
C.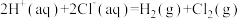 的 的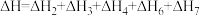 |
D.中和热可表示为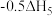 |
您最近一年使用:0次
2021-03-06更新
|
652次组卷
|
9卷引用:重庆市西南大学附属中学校2022-2023学年高三上学期开学定时训练化学试题
重庆市西南大学附属中学校2022-2023学年高三上学期开学定时训练化学试题(已下线)2022年重庆高考真题化学试题变式题(选择题11-14)重庆市第十一中学校2023-2024学年高三上学期10月月考化学试题浙江省台州市2021届高三11月选考科目教学质量评估(一模)试题化学学科(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)
5 . 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
已知:①C4H10(g)+ O2(g)=C4H8(g)+H2O(g) △H1=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) △H1=-119 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) △H2=-242 kJ·mol-1
O2(g)=H2O(g) △H2=-242 kJ·mol-1
丁烷(C4H10)脱氢制丁烯(C4H8)的热化学方程式为C4H10(g) C4H8(g)+H2(g) △H3
C4H8(g)+H2(g) △H3
下列措施一定能提高该反应中丁烯产率的是
已知:①C4H10(g)+
 O2(g)=C4H8(g)+H2O(g) △H1=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) △H1=-119 kJ·mol-1②H2(g)+
 O2(g)=H2O(g) △H2=-242 kJ·mol-1
O2(g)=H2O(g) △H2=-242 kJ·mol-1丁烷(C4H10)脱氢制丁烯(C4H8)的热化学方程式为C4H10(g)
 C4H8(g)+H2(g) △H3
C4H8(g)+H2(g) △H3下列措施一定能提高该反应中丁烯产率的是
| A.增大压强,升高温度 | B.升高温度,减小压强 |
| C.降低温度,增大压强 | D.减小压强,降低温度 |
您最近一年使用:0次
2021-02-05更新
|
236次组卷
|
6卷引用:重庆市二0三中学2022-2023学年高二上学期第一次月考化学试题
重庆市二0三中学2022-2023学年高二上学期第一次月考化学试题湖南省临澧县第一中学2020-2021学年高二上学期期末考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题四川省射洪中学校2023-2024学年高二上学期9月月考化学试题
名校
解题方法
6 . 已知 (g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为
(g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为
 (g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为
(g)+H2(g)→CH3CH2CH3(g) △H=-157 kJ/mol。已知环丙烷(g)的燃烧热△H=-2092 kI/mol,丙烷(g)的燃烧热△H=-2220 kJ/mol,1 mol液态水蒸发为气态水的焓变为△H=+44 kJ/mol。则 2 mol氢气完全燃烧生成气态水的△H(kJ/mol)为| A.-658 | B.-482 | C.-329 | D.-285 |
您最近一年使用:0次
2021-01-25更新
|
805次组卷
|
4卷引用:重庆市2021年普通高中学业水平选择考适应性测试化学试题
重庆市2021年普通高中学业水平选择考适应性测试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练河南省焦作市博爱县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 反应2C(s)+O2(g)=2CO(g)的能量变化如下图所示。下列说法正确的是


| A.C(s)与一定量O2(g)反应生成14g CO(g)放出的热量为110.5kJ |
| B.该反应的热化学方程式:2C(s)+O2(g)=2CO(g) ΔH=-221kJ |
| C.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
| D.2mol C(s)与足量O2(g)充分反应,生成CO2(g),放出的热量大于221kJ |
您最近一年使用:0次
8 . (1)由金红石(TiO2)制取单质Ti,涉及到的部分步骤为:TiO2→TiCl4→Ti
已知:①C(s)+O2(g)=CO2(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的△H=_____________________ 。
(2)25℃、1.01×105 Pa时,2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.7 kJ/mol,该反应在_______ (填“高温”或“低温”)条件下能自发进行。
(3)①一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g) ⇌3N2(g)+4H2O(1) △H < 0 ,下列不能说明反应达到平衡状态的是________ 。(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
②在10 L的密闭容器中发生上述反应,容器内部分物质的量变化如下表:
前2min内NO2的平均反应速率为__________ 。
平衡时NO2的转化率___________ ;
该温度下应的平衡常数K=_____ 。
反应在第6min时改变了条件,改变的条件可能是______ 。(填序号)
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
已知:①C(s)+O2(g)=CO2(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的△H=
(2)25℃、1.01×105 Pa时,2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.7 kJ/mol,该反应在
(3)①一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g) ⇌3N2(g)+4H2O(1) △H < 0 ,下列不能说明反应达到平衡状态的是
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
②在10 L的密闭容器中发生上述反应,容器内部分物质的量变化如下表:
物质的量/mol 时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
前2min内NO2的平均反应速率为
平衡时NO2的转化率
该温度下应的平衡常数K=
反应在第6min时改变了条件,改变的条件可能是
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:
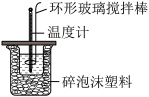
①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?________________________________ 。
(2)倒入NaOH溶液的正确操作是__________ (填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________ 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(6)该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是_____
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
Ⅲ .25℃,101KPa时,1 g甲烷完全燃烧生成稳定的氧化物,放出55.8 kJ热量,请写出甲烷燃烧热的热化学方程式____________________ 。(结果取整数)
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(6)该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
Ⅲ .25℃,101KPa时,1 g甲烷完全燃烧生成稳定的氧化物,放出55.8 kJ热量,请写出甲烷燃烧热的热化学方程式
您最近一年使用:0次
名校
解题方法
10 . CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生如下三个竞争反应:
反应ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
反应ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
反应ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_______ 。
(2)反应ⅲ为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示( 为催化剂,
为催化剂, 为O原子,
为O原子, 为C原子,
为C原子, 为H原子):
为H原子):
历程I:
历程II:
历程III:
①历程Ⅰ方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热ΔH_______ 0(填“>”或“<”)。
②反应历程Ⅱ方框内的方程式是_______ 。
③反应历程中_______ (填“历程I”“历程II”或“历程III”)是RWGS的控速步骤。
(3)电解法转化CO2可实现CO2资源化利用,电解CO2制HCOOH的原理示意图如图。

①a、b表示CO2进气管,其中_______ (填“a”或“b”)管是不需要的。
②写出阴极的电极反应式:_______ 。
③电解一段时间后,若两侧电解液中K+物质的量相差为0.04 mol,则阳极池产生的气体在标准状况下的总体积为_______ L(假设产生的气体全部逸出)。
反应ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ/mol反应ⅱ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol
CH4(g)+2H2O(g) ΔH2=-165.0 kJ/mol反应ⅲ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3=+41.17 kJ/mol
CO(g)+H2O(g) ΔH3=+41.17 kJ/mol回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为
(2)反应ⅲ为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(
 为催化剂,
为催化剂, 为O原子,
为O原子, 为C原子,
为C原子, 为H原子):
为H原子):历程I:

历程II:

历程III:

①历程Ⅰ方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热ΔH
②反应历程Ⅱ方框内的方程式是
③反应历程中
(3)电解法转化CO2可实现CO2资源化利用,电解CO2制HCOOH的原理示意图如图。

①a、b表示CO2进气管,其中
②写出阴极的电极反应式:
③电解一段时间后,若两侧电解液中K+物质的量相差为0.04 mol,则阳极池产生的气体在标准状况下的总体积为
您最近一年使用:0次



