解题方法
1 . 通过实验与计算机模拟,发现在金催化剂表面上反应 的历程如图所示(其中吸附在催化剂表面上的物种用·标注)。下列相关说法
的历程如图所示(其中吸附在催化剂表面上的物种用·标注)。下列相关说法不正确 的是
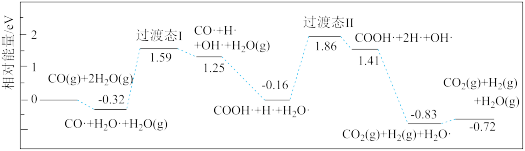
 的历程如图所示(其中吸附在催化剂表面上的物种用·标注)。下列相关说法
的历程如图所示(其中吸附在催化剂表面上的物种用·标注)。下列相关说法
| A.在经历“过渡态Ⅰ”的过程中部分H—O键发生断裂 |
B.经历“过渡态Ⅱ”的反应 需要吸收能量1.57ev 需要吸收能量1.57ev |
C.在金催化剂作用下,  |
D.使用金做催化剂,能减小反应 的焓变 的焓变 |
您最近一年使用:0次
2 . 下列说法不正确 的是
A.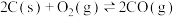 的反应热无法直接测得,可通过C和CO的燃烧热间接求得 的反应热无法直接测得,可通过C和CO的燃烧热间接求得 |
| B.硝酸具有腐蚀性和挥发性,使用时须注意防护与通风 |
| C.利用X射线衍射实验可以测定晶胞中的原子坐标,并通过计算判断分子的空间结构 |
D.NaCl溶液中的Ca2+、 可以通过先加Na2CO3溶液,再加BaCl2溶液和盐酸除去 可以通过先加Na2CO3溶液,再加BaCl2溶液和盐酸除去 |
您最近一年使用:0次
2022-11-28更新
|
191次组卷
|
2卷引用:浙江省9+1高中联盟2022-2023学年高三上学期期中考试化学试题
名校
解题方法
3 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
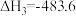 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

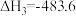 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
954次组卷
|
7卷引用:北京市海淀区2021-2022学年高三上学期期中考试化学试题
北京市海淀区2021-2022学年高三上学期期中考试化学试题天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应
名校
4 . 已知 下:①
下:①
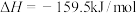
②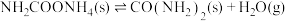
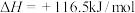
在该温度下,向刚性容器中投入足量 ,达平衡后测得容器内的总压为
,达平衡后测得容器内的总压为 ,且
,且 的分压等于
的分压等于 的分压,下列说法正确的是
的分压,下列说法正确的是
 下:①
下:①
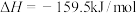
②
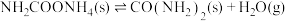
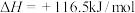
在该温度下,向刚性容器中投入足量
 ,达平衡后测得容器内的总压为
,达平衡后测得容器内的总压为 ,且
,且 的分压等于
的分压等于 的分压,下列说法正确的是
的分压,下列说法正确的是A.反应②的 为 为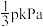 |
B.若温度不变,缩小容器的体积达新平衡后, 的分压减小 的分压减小 |
C.若升高温度, 的体积分数减小 的体积分数减小 |
D.若保持温度不变,再通入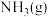 , , 的分压增大 的分压增大 |
您最近一年使用:0次
名校
解题方法
5 . 化学反应与能量
(1)已知



设有氢气和丙烷的混合气体5mol,完全燃烧时放出热量为3847kJ,则混合气体中氢气与丙烷的体积比是_______ 。
(2)甲醇( )广泛用作燃料电池的燃料,可由天然气来合成,已知:
)广泛用作燃料电池的燃料,可由天然气来合成,已知:
①

②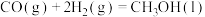
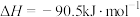
③
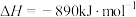
则甲醇的燃烧热为_______ 。
(3)向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量是5.12kJ。向足量的
溶液,放出的热量是5.12kJ。向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量为2.2kJ。则
溶液,放出的热量为2.2kJ。则 溶液与
溶液与 溶液反应的热化学方程式为
溶液反应的热化学方程式为


_______ 。
(4)已知:
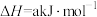

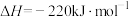
 、
、 和
和 键的键能分别为436、496和
键的键能分别为436、496和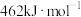 ,则a为
,则a为_______ 。
(1)已知




设有氢气和丙烷的混合气体5mol,完全燃烧时放出热量为3847kJ,则混合气体中氢气与丙烷的体积比是
(2)甲醇(
 )广泛用作燃料电池的燃料,可由天然气来合成,已知:
)广泛用作燃料电池的燃料,可由天然气来合成,已知:①


②
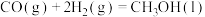
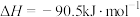
③

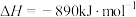
则甲醇的燃烧热为
(3)向足量的
 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量是5.12kJ。向足量的
溶液,放出的热量是5.12kJ。向足量的 溶液中加入100mL
溶液中加入100mL 的
的 溶液,放出的热量为2.2kJ。则
溶液,放出的热量为2.2kJ。则 溶液与
溶液与 溶液反应的热化学方程式为
溶液反应的热化学方程式为

(4)已知:

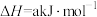

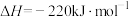
 、
、 和
和 键的键能分别为436、496和
键的键能分别为436、496和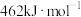 ,则a为
,则a为
您最近一年使用:0次
6 . 氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)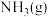 和
和 反应生成
反应生成 和
和 的
的 往往难以直接测量,从产物稳定性看,其主要原因是
往往难以直接测量,从产物稳定性看,其主要原因是_______ 。
已知: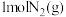 反应生成
反应生成 的
的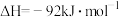 ,
,
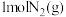 和
和 完全反应生成
完全反应生成 的
的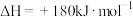 ,
,
 燃烧生成
燃烧生成 的
的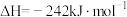 ,若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
,若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______ 。
(2)甲烷与水蒸气通入聚焦太阳能反应器,发生反应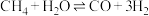 ,该反应为吸热反应。已知在三种不同条件(I、II、III)下,氢气的产量随时间的变化如图1所示。
,该反应为吸热反应。已知在三种不同条件(I、II、III)下,氢气的产量随时间的变化如图1所示。
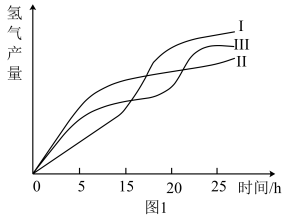
①在0~20小时内,甲烷的反应速率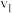 、
、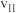 和
和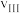 从大到小的顺序为
从大到小的顺序为_______ 。
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为 ,则该条件下此反应的平衡常数K=
,则该条件下此反应的平衡常数K=_______ ,甲烷的转化率为_______ 。
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示。平衡状态由A变到B时,对应的平衡常数:
_______ 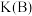 (填“>”、“<"或“=”)。
(填“>”、“<"或“=”)。
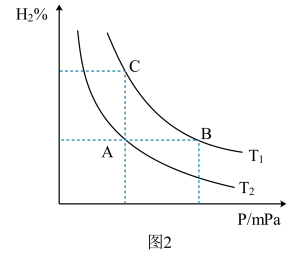
(1)
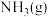 和
和 反应生成
反应生成 和
和 的
的 往往难以直接测量,从产物稳定性看,其主要原因是
往往难以直接测量,从产物稳定性看,其主要原因是已知:
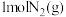 反应生成
反应生成 的
的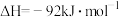 ,
,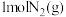 和
和 完全反应生成
完全反应生成 的
的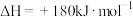 ,
, 燃烧生成
燃烧生成 的
的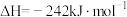 ,若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
,若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(2)甲烷与水蒸气通入聚焦太阳能反应器,发生反应
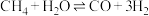 ,该反应为吸热反应。已知在三种不同条件(I、II、III)下,氢气的产量随时间的变化如图1所示。
,该反应为吸热反应。已知在三种不同条件(I、II、III)下,氢气的产量随时间的变化如图1所示。
①在0~20小时内,甲烷的反应速率
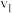 、
、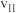 和
和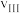 从大到小的顺序为
从大到小的顺序为②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为
 ,则该条件下此反应的平衡常数K=
,则该条件下此反应的平衡常数K=③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示。平衡状态由A变到B时,对应的平衡常数:

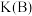 (填“>”、“<"或“=”)。
(填“>”、“<"或“=”)。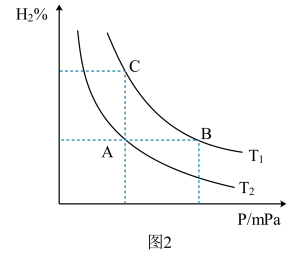
您最近一年使用:0次
2022-11-16更新
|
45次组卷
|
2卷引用:河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题
7 . 甲烷—二氧化碳重整和甲烷水蒸气—二氧化碳双重整技术(CSCRM)均能将 和
和 温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
回答下列问题:
Ⅰ.甲烷—二氧化碳重整: 重整
重整 的催化转化原理如图1所示。
的催化转化原理如图1所示。

(1)已知相关反应的能量变化如图2所示。

则过程i的热化学方程式为_______ 。
(2)过程ii的总反应可表示为_______ 。
(3)向一刚性密闭容器中,充入物质的量比为 的
的 和
和 ,总压为
,总压为 ,加热到一定温度使其发生过程i的反应。
,加热到一定温度使其发生过程i的反应。
①达到平衡后测得体系压强是起始时的1.76倍,则该反应的平衡常数的计算式为
_______ 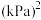 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。
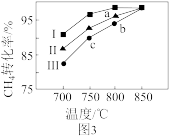
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应进行相同时间后, 的转化率随反应温度的变化如图3所示。a点所代表的状态
的转化率随反应温度的变化如图3所示。a点所代表的状态_______ (填“是”或“不是”)平衡状态;b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
Ⅱ.甲烷水蒸气—二氧化碳双重整技术(CSCRM):在原料气中通入水蒸气来缓解积碳,发生的主要反应的 与温度关系如图4,已知各反应原理如下,其中
与温度关系如图4,已知各反应原理如下,其中 与
与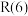 为积碳反应。
为积碳反应。

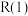
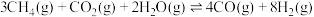

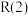


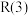


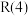
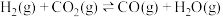

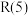
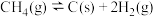

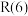

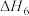
(4)
_______ 0(填“>”或“<”)。
(5)已知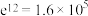 ,综合分析进料气
,综合分析进料气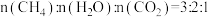 时制备合成气的最佳温度为
时制备合成气的最佳温度为_______ ;通入水蒸气能缓解积碳的原因为_______ 。
 和
和 温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。
温室气体转化为高附加值的合成气,在环保、经济等方面均具有重大意义。回答下列问题:
Ⅰ.甲烷—二氧化碳重整:
 重整
重整 的催化转化原理如图1所示。
的催化转化原理如图1所示。
(1)已知相关反应的能量变化如图2所示。

则过程i的热化学方程式为
(2)过程ii的总反应可表示为
(3)向一刚性密闭容器中,充入物质的量比为
 的
的 和
和 ,总压为
,总压为 ,加热到一定温度使其发生过程i的反应。
,加热到一定温度使其发生过程i的反应。①达到平衡后测得体系压强是起始时的1.76倍,则该反应的平衡常数的计算式为

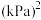 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应进行相同时间后,
 的转化率随反应温度的变化如图3所示。a点所代表的状态
的转化率随反应温度的变化如图3所示。a点所代表的状态 的转化率高于c点,原因是
的转化率高于c点,原因是
Ⅱ.甲烷水蒸气—二氧化碳双重整技术(CSCRM):在原料气中通入水蒸气来缓解积碳,发生的主要反应的
 与温度关系如图4,已知各反应原理如下,其中
与温度关系如图4,已知各反应原理如下,其中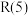 与
与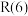 为积碳反应。
为积碳反应。
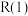
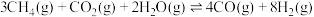

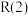


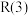


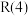
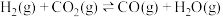

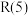
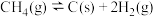

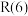

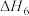
(4)

(5)已知
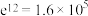 ,综合分析进料气
,综合分析进料气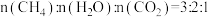 时制备合成气的最佳温度为
时制备合成气的最佳温度为
您最近一年使用:0次
2022-11-15更新
|
119次组卷
|
2卷引用:山东省青岛市(胶州市、城阳区、平度市、黄岛区)2022-2023学年高二上学期期中考试化学试题
8 . 北京时间2022年9月26日21时38分,我国在西昌卫星发射中心使用长征二号丁运载火箭,成功将遥感三十六号卫星发射升空,卫星顺利进入预定轨道,发射任务获得圆满成功。联氨 是航天飞常用的高能燃料,火箭推进器中分别装有液态
是航天飞常用的高能燃料,火箭推进器中分别装有液态 (联氨)和液态
(联氨)和液态 ,当它们混合时即产生气体,放出大量热。已知:
,当它们混合时即产生气体,放出大量热。已知:
I.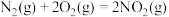

II.
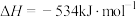
III.
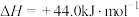
Ⅳ.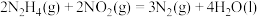
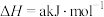
则a等于
 是航天飞常用的高能燃料,火箭推进器中分别装有液态
是航天飞常用的高能燃料,火箭推进器中分别装有液态 (联氨)和液态
(联氨)和液态 ,当它们混合时即产生气体,放出大量热。已知:
,当它们混合时即产生气体,放出大量热。已知:I.
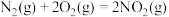

II.

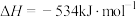
III.

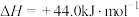
Ⅳ.
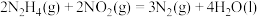
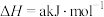
则a等于
| A.959.7 | B.-1135.7 | C.-1179.7 | D.-1311.7 |
您最近一年使用:0次
9 .  的回收与利用是科学家研究的热点课题,工业上有一种用
的回收与利用是科学家研究的热点课题,工业上有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
 kJ·mol
kJ·mol .将6 mol
.将6 mol  和8 mol
和8 mol  充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
(1)已知
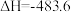 kJ·mol
kJ·mol .依据题中信息计算反应:
.依据题中信息计算反应: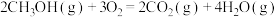

______ kJ·mol .
.
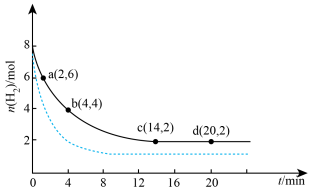
(2)a点正反应速率______ (填大于、等于或小于)逆反应速率,前4 min内,用 表示的平均反应速率为
表示的平均反应速率为______ mol·L ·min
·min 。
。
(3)平衡时氢气的转化率a=______ ,该条件下反应的平衡常数
______ 。
(4)二氧化碳催化加氢也可以合成乙烯,该反应是综合利用 的热点研究领域。
的热点研究领域。 催化加氢生成乙烯和水的反应中,产物的物质的量之比
催化加氢生成乙烯和水的反应中,产物的物质的量之比
______ 。当反应达到平衡时,若增大压强,则
______ (填“变大”“变小”或“不变”)。
 的回收与利用是科学家研究的热点课题,工业上有一种用
的回收与利用是科学家研究的热点课题,工业上有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
 kJ·mol
kJ·mol .将6 mol
.将6 mol  和8 mol
和8 mol  充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。
充入2 L的密闭容器中,测得的物质的量随时间变化如图所示(实线)。(1)已知

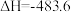 kJ·mol
kJ·mol .依据题中信息计算反应:
.依据题中信息计算反应: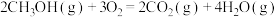

 .
.
(2)a点正反应速率
 表示的平均反应速率为
表示的平均反应速率为 ·min
·min 。
。(3)平衡时氢气的转化率a=

(4)二氧化碳催化加氢也可以合成乙烯,该反应是综合利用
 的热点研究领域。
的热点研究领域。 催化加氢生成乙烯和水的反应中,产物的物质的量之比
催化加氢生成乙烯和水的反应中,产物的物质的量之比

您最近一年使用:0次
10 . 反应热计算是一种基本化学能力。
(1)已知相关的化学键键能数据如下:
CO(g)+2H2(g)  CH3OH(g) ΔH=
CH3OH(g) ΔH=_______ kJ·mol-1
(2)水煤气变换反应CO(g)+H2O(g) CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
由表中数据计算WGS反应的焓变ΔH=___________ kJ/mol。
(3)已知: N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
则反应4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=_______ kJ/mol
(4)已知下列物质的相对能量如图,则C2H6(g)+2CO2(g)=4CO(g)+3H2(g) ΔH=___ kJ/mol

(1)已知相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
E/( ) ) | 436 | 343 | 1076 | 465 | 413 |
 CH3OH(g) ΔH=
CH3OH(g) ΔH=(2)水煤气变换反应CO(g)+H2O(g)
 CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。基元反应 | 正逆反应活化能 | ||
| E正反应 | E逆反应 | ||
| ① | H2O+* H2O* H2O* | 0 | 67 |
| ② | H2O*+* OH*+H* OH*+H* | 150 | 0 |
| ③ | OH*+* O*+H* O*+H* | 71 | 67 |
| ④ | 2H*+* H2+2* H2+2* | 74 | 25 |
| ⑤ | CO+* CO* CO* | 0 | 42 |
| ⑥ | CO*+O* CO2*+* CO2*+* | 37 | 203 |
| ⑦ | CO2* CO2+* CO2+* | 17 | 0 |
(3)已知: N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
则反应4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=
(4)已知下列物质的相对能量如图,则C2H6(g)+2CO2(g)=4CO(g)+3H2(g) ΔH=

您最近一年使用:0次



