1 . 卤素的单质和化合物在生产和生活中应用广泛。
(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
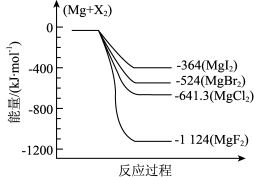
①图中四种MgX2的热稳定由小到大的顺序是:_______ 。
②MgBr2(s)+Cl2(g) MgCl2(s)+Br2(g) △H=
MgCl2(s)+Br2(g) △H=_______ kJ∙mol-1。
某温度下,在密闭恒容容器中放入一定量MgBr2(s)和Cl2(g)进行该反应,一定时间后不能说明该反应已经达到平衡的是_______ 。(选填序号)。
A.容器内的压强不再改变 B.混合气体的密度不再改变
C.混合气体的颜色不再改变 D.混合气体的平均相对分子质量不再改变
E.容器内的固体的质量不再改变
③工业上用金属Mg与I2反应制取MgI2时,常加入少量水,水的作用是_______ 。
④AgBr常用作感光剂和镇静剂,工业制得的AgBr固体常含有AgCl固体。现有含AgCl质量分数为14.35%的AgBr固体100.00g,可用饱和KBr溶液一次性浸泡,恰好溶解除去AgCl固体,需要5.015 mol∙L-1的饱和KBr溶液的体积至少为_______ mL。(保留4位有效数字)(已知常温下Ksp(ABr)=5.418×10-13,Ksp(AgCl)=1.806×10-10)
(2)将一定量的PCl5(g)在T℃、Po压强下发生反应:PCl5(g) PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=
PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=_______ 。(用含a的式子表示。其中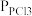 、
、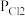 、
、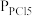 为各组分的平衡分压,如
为各组分的平衡分压,如 ,p为平衡总压,
,p为平衡总压, 为平衡系统中PCl5的物质的量分数)
为平衡系统中PCl5的物质的量分数)
(3)向11mL0.40mol∙L-1H2O2溶液中加入适量FeCl3溶液,16分钟时测得生成O2的体积(已折算为标准状况)为44.8mL。资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。反应过程中能量变化如图1所示,在图2中画出在0~16分钟内产生O2的物质的量随时间的变化示意图_______ 。

(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

①图中四种MgX2的热稳定由小到大的顺序是:
②MgBr2(s)+Cl2(g)
 MgCl2(s)+Br2(g) △H=
MgCl2(s)+Br2(g) △H=某温度下,在密闭恒容容器中放入一定量MgBr2(s)和Cl2(g)进行该反应,一定时间后不能说明该反应已经达到平衡的是
A.容器内的压强不再改变 B.混合气体的密度不再改变
C.混合气体的颜色不再改变 D.混合气体的平均相对分子质量不再改变
E.容器内的固体的质量不再改变
③工业上用金属Mg与I2反应制取MgI2时,常加入少量水,水的作用是
④AgBr常用作感光剂和镇静剂,工业制得的AgBr固体常含有AgCl固体。现有含AgCl质量分数为14.35%的AgBr固体100.00g,可用饱和KBr溶液一次性浸泡,恰好溶解除去AgCl固体,需要5.015 mol∙L-1的饱和KBr溶液的体积至少为
(2)将一定量的PCl5(g)在T℃、Po压强下发生反应:PCl5(g)
 PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=
PCl3(g)+Cl2(g),测得平衡时PCl5的分解率为a,求该温度下此反应的平衡常数Kp=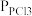 、
、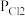 、
、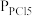 为各组分的平衡分压,如
为各组分的平衡分压,如 ,p为平衡总压,
,p为平衡总压, 为平衡系统中PCl5的物质的量分数)
为平衡系统中PCl5的物质的量分数)(3)向11mL0.40mol∙L-1H2O2溶液中加入适量FeCl3溶液,16分钟时测得生成O2的体积(已折算为标准状况)为44.8mL。资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+=2Fe3++2H2O。反应过程中能量变化如图1所示,在图2中画出在0~16分钟内产生O2的物质的量随时间的变化示意图

您最近一年使用:0次
解题方法
2 . 北京2022年冬奥会期间,超1000辆氢能源汽车为冬奥会服务。氢能源作为绿色能源具有广阔的发展空间,但氢能源的来源成为制约其发展的一个瓶颈。回答下列问题:
(1)氢能源的工业生产来源之一是天然气,如甲烷的重整反应(重整反应时伴随积碳副反应):
①重整反应的焓变
_______ 。
②在恒压密闭容器中按投料比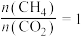 投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
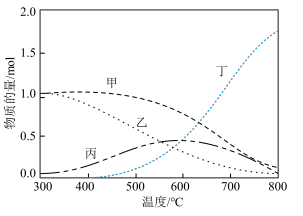
甲表示的物质是_______ (填化学式),温度低于400℃时积碳很少,但实际生产却采用高于400℃的温度,原因是_______ 。
(2)在恒温(T)、恒压( )密闭容器中,按投料比
)密闭容器中,按投料比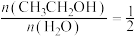 投料,发生反应:
投料,发生反应: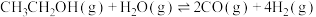
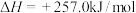 。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
_______ ,乙醇的转化率为_______ 。
(3)利用天然气分解也可制备 ,反应如下:
,反应如下:
反应Ⅲ: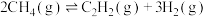

反应Ⅳ:

已知: 、
、 分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
通过实验测得反应Ⅲ的正反应速率和逆反应速率方程: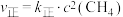 ,
,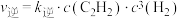 。一定温度时测得
。一定温度时测得 ,则该温度时的平衡常数
,则该温度时的平衡常数
_____ 。
(1)氢能源的工业生产来源之一是天然气,如甲烷的重整反应(重整反应时伴随积碳副反应):
| 重整反应 | 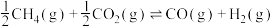  | |
| 积碳反应 | I | 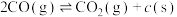 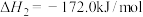 |
| II | 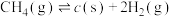 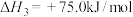 | |

②在恒压密闭容器中按投料比
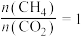 投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
甲表示的物质是
(2)在恒温(T)、恒压(
 )密闭容器中,按投料比
)密闭容器中,按投料比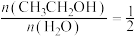 投料,发生反应:
投料,发生反应: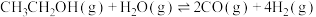
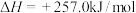 。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
(3)利用天然气分解也可制备
 ,反应如下:
,反应如下:反应Ⅲ:
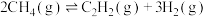

反应Ⅳ:


已知:
 、
、 分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。通过实验测得反应Ⅲ的正反应速率和逆反应速率方程:
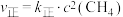 ,
,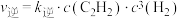 。一定温度时测得
。一定温度时测得 ,则该温度时的平衡常数
,则该温度时的平衡常数
您最近一年使用:0次
2022-12-23更新
|
314次组卷
|
3卷引用: 河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题
河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)河南省郑州市等3地2022-2023学年高三上学期12月月考化学试题
解题方法
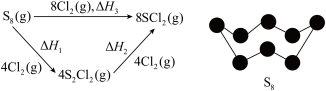
3 . 已知: 、
、 广泛用于化工合成作硫化剂、氯化剂。
广泛用于化工合成作硫化剂、氯化剂。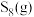 与氯气在一定条件下反应如图所示。已知
与氯气在一定条件下反应如图所示。已知 键的键能为
键的键能为 。下列叙述正确的是
。下列叙述正确的是
 、
、 广泛用于化工合成作硫化剂、氯化剂。
广泛用于化工合成作硫化剂、氯化剂。 与氯气在一定条件下反应如图所示。已知
与氯气在一定条件下反应如图所示。已知 键的键能为
键的键能为 。下列叙述正确的是
。下列叙述正确的是
A. |
B. |
C. |
D.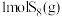 与氯气一步生成 与氯气一步生成 放出的热量比两步的多 放出的热量比两步的多 |
您最近一年使用:0次
名校
解题方法
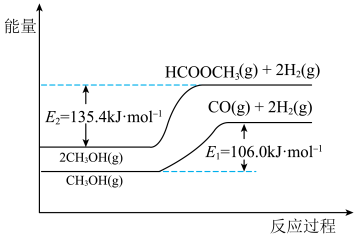
4 . 工业上常用甲醇脱氢制重要的化工产品“万能中间体—— ”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:
”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:
反应I:

反应II: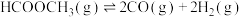

反应III:

反应I、III的能量变化如图所示,下列说法正确的是
 ”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:
”,具有工艺流程短、原料单一、反应条件温和等优点。该工艺过程涉及如下反应:反应I:


反应II:
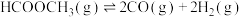

反应III:


反应I、III的能量变化如图所示,下列说法正确的是

| A.液态水转化为气态水也和反应I一样属于吸热反应 |
B.三者K值之间的关系为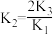 |
C.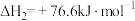 |
D.反应III:升高温度或者是增大压强, 的百分含量都会增大 的百分含量都会增大 |
您最近一年使用:0次
2022-12-15更新
|
131次组卷
|
2卷引用:湖南省长沙市A佳教育联盟2022-2023学年高二上学期第三次月考化学试题
5 . 在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是
物质 | S/(J·K−1·mol−1) | ∆H/(kJ·mol−1) | ρ/(kg·m−3) |
C(金刚石) | 2.4 | −395.40 | 3513 |
C(石墨) | 5.7 | −393.51 | 2260 |
| A.该反应的∆H<0,∆S<0 |
| B.由公式∆G=∆H−T∆S可知,该反应∆G=985.29kJ·mol−1 |
| C.金刚石比石墨稳定 |
| D.超高压条件下,石墨有可能变为金刚石 |
您最近一年使用:0次
2022-12-15更新
|
601次组卷
|
2卷引用: 浙江省丽水、湖州、衢州 2022 年 11 月三地市高三教学质量检测(一模)化学试题
解题方法
6 . 回答下列问题
(1)一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
已知:①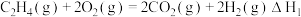
②
③
④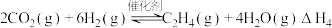
则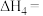
__________  用
用 、
、 、
、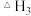 表示
表示 。
。
(2)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ ”表示。
”表示。

由图可知合成氨反应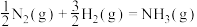 的
的
__________  。该历程中反应速率最慢的步骤的化学方程式为
。该历程中反应速率最慢的步骤的化学方程式为__________ 。
(3)用 和天然气生产
和天然气生产 的反应为
的反应为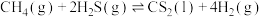 。
。
已知:I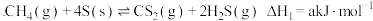
II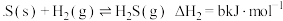
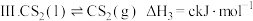
则反应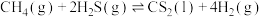 的
的
__________ 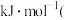 用含
用含 、
、 、
、 的代数式表示
的代数式表示 。
。
(4)已知:①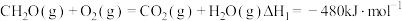 ;
;
②相关化学键的键能数据如表所示:
则
__________ 。
(1)一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
已知:①
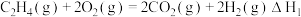
②

③

④
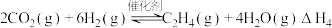
则
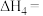
 用
用 、
、 、
、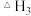 表示
表示 。
。(2)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“
 ”表示。
”表示。
由图可知合成氨反应
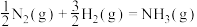 的
的
 。该历程中反应速率最慢的步骤的化学方程式为
。该历程中反应速率最慢的步骤的化学方程式为(3)用
 和天然气生产
和天然气生产 的反应为
的反应为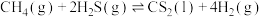 。
。已知:I
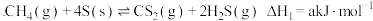
II
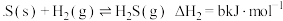
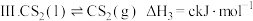
则反应
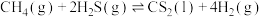 的
的
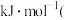 用含
用含 、
、 、
、 的代数式表示
的代数式表示 。
。(4)已知:①
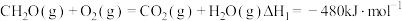 ;
;②相关化学键的键能数据如表所示:
| 化学键 | O=O | H-H | O-H |
| 键能/(kJ/mol) | 498 | 436 | 464 |

您最近一年使用:0次
解题方法
7 . 填空。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=_______ 。
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:
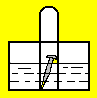
若液面上升,发生_______ 腐蚀(填“析氢”或“吸氧”),负极电极反应式:_______ ,正极电极反应式:_______
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是_______ 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:

若液面上升,发生
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是
您最近一年使用:0次
8 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是____ 。

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为____ mol•L-1。
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)

(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,

您最近一年使用:0次
2022-12-08更新
|
462次组卷
|
2卷引用:江苏省苏州中学、淮阴中学、姜堰中学、海门中学四校2023届高三上学期期中联考化学试题
9 . 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)汽车尾气中的 、
、 、
、 等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①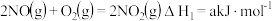
②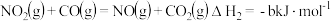
③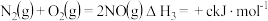
则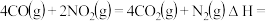
_______ kJ/mol。
(2)改善能源结构是治理雾霾问题的最直接有效途径。甲醇是一种清洁能源,可用水煤气在催化剂下制备,其反应为: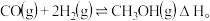 将
将 和
和 充入一容积为
充入一容积为 的密闭容器中,分别在
的密闭容器中,分别在 、
、 下发生反应,根据如图回答问题:
下发生反应,根据如图回答问题:
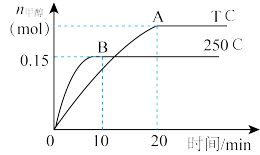
①写出该反应的平衡常数表达式
_______ ;反应达平衡后,其他条件不变,若缩小容积, 体积分数
体积分数_______ (填“增大”、“减小”或“不变”)。
②250℃时,反应前 的平均速率
的平均速率
_______ ,平衡时 的转化率
的转化率
_______ 。
③温度比较:T℃_______ 250℃(填“ ”“
”“ ”或“
”或“ ”);ΔH
”);ΔH_______ 0(填“ ”、“
”、“ ”或“
”或“ ”)
”)
(3)炭黑是雾霾的重要颗粒物,研究发现它能活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化 下列说法不正确的是_______。
下列说法不正确的是_______。

(1)汽车尾气中的
 、
、 、
、 等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。已知:①
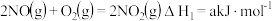
②
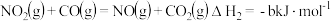
③
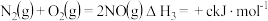
则
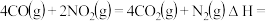
(2)改善能源结构是治理雾霾问题的最直接有效途径。甲醇是一种清洁能源,可用水煤气在催化剂下制备,其反应为:
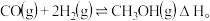 将
将 和
和 充入一容积为
充入一容积为 的密闭容器中,分别在
的密闭容器中,分别在 、
、 下发生反应,根据如图回答问题:
下发生反应,根据如图回答问题:
①写出该反应的平衡常数表达式

 体积分数
体积分数②250℃时,反应前
 的平均速率
的平均速率
 的转化率
的转化率
③温度比较:T℃
 ”“
”“ ”或“
”或“ ”);ΔH
”);ΔH ”、“
”、“ ”或“
”或“ ”)
”)(3)炭黑是雾霾的重要颗粒物,研究发现它能活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化
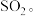 下列说法不正确的是_______。
下列说法不正确的是_______。
A.每活化一个氧分子吸收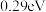 能量 能量 |
B.水可使氧分子活化反应的活化能降低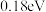 |
C.氧分子的活化是 键的断裂与 键的断裂与 键的生成过程 键的生成过程 |
D.炭黑颗粒是大气中 转化为 转化为 的催化剂 的催化剂 |
您最近一年使用:0次
2022-12-03更新
|
62次组卷
|
3卷引用:安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试(实验班)化学试题
名校
10 . 在标准状况下, 纯物质的规定熵,叫做标准摩尔熵,用符号
纯物质的规定熵,叫做标准摩尔熵,用符号 表示。相关数据如下表,通过数据分析得出的下列结论不正确的是
表示。相关数据如下表,通过数据分析得出的下列结论不正确的是
 纯物质的规定熵,叫做标准摩尔熵,用符号
纯物质的规定熵,叫做标准摩尔熵,用符号 表示。相关数据如下表,通过数据分析得出的下列结论不正确的是
表示。相关数据如下表,通过数据分析得出的下列结论不正确的是| 物质 |  |  |  |  |  |  |  | 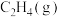 |
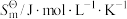 | 191.6 | 205.2 | 173.8 | 186.9 | 197.7 | 210.8 | 213.8 | 219.3 |
| A.相对分子质量相同的分子,分子对称性越差,结构越复杂,标准摩尔熵越大 |
| B.组成和结构相似的分子,相对分子质量越大,标准摩尔熵越大 |
C.反应 的标准摩尔熵变 的标准摩尔熵变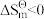 |
D.推测羰基硫 的标准摩尔熵大于 的标准摩尔熵大于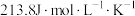 |
您最近一年使用:0次



