1 . 研究含氮化合物对消除环境污染,能源结构的改变,食品添加剂的研究等有重要意义。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。

①在H、N、O、C、 元素中,不属于P区元素的有:
元素中,不属于P区元素的有:_______
②基态O原子最高能级的原子轨道形状是_______
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要的作用。
①基态N原子的价层电子的轨道表示式为_______ 。
②基态 原子的价层电子排布式为
原子的价层电子排布式为_______ 。
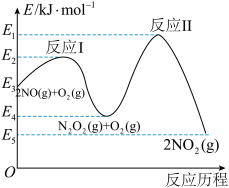
(3) 在空气中存在如下反应:
在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:_______
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物( 、
、 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
Ⅰ.
II.
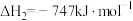
若 的燃烧热为283.5
的燃烧热为283.5 ,则反应Ⅰ的
,则反应Ⅰ的
_______ 
(5)已知1 化学键断开吸收或生成时释放的能量如下:
化学键断开吸收或生成时释放的能量如下: 436
436 ,
, 193
193 ,
, 946
946 。已知:
。已知: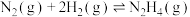
 ,则生成1
,则生成1
 释放的能量是
释放的能量是_______  。
。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。

①在H、N、O、C、
 元素中,不属于P区元素的有:
元素中,不属于P区元素的有:②基态O原子最高能级的原子轨道形状是
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要的作用。
①基态N原子的价层电子的轨道表示式为
②基态
 原子的价层电子排布式为
原子的价层电子排布式为(3)
 在空气中存在如下反应:
在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(
 、
、 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:Ⅰ.

II.

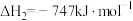
若
 的燃烧热为283.5
的燃烧热为283.5 ,则反应Ⅰ的
,则反应Ⅰ的

(5)已知1
 化学键断开吸收或生成时释放的能量如下:
化学键断开吸收或生成时释放的能量如下: 436
436 ,
, 193
193 ,
, 946
946 。已知:
。已知: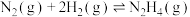
 ,则生成1
,则生成1
 释放的能量是
释放的能量是 。
。
您最近一年使用:0次
名校
解题方法
2 . 甲烷除做燃料外,还可用于化工合成及其他应用。
(1) 可用于消除氮氧化物,反应原理如下:
可用于消除氮氧化物,反应原理如下:
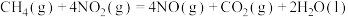
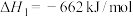
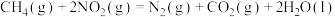
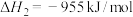


_______ kJ/mol
(2) 可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ)
可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ) ,(ⅱ)
,(ⅱ)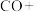
 ,过程中可能发生的副反应为
,过程中可能发生的副反应为_______ ;某条件下按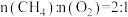 进行反应(ⅰ),各物质的量随时间变化如图,其中表示
进行反应(ⅰ),各物质的量随时间变化如图,其中表示 和CO的曲线分别为
和CO的曲线分别为_______ 。 ,(ⅱ)
,(ⅱ)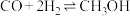 ;某温度下,向2L恒容密闭容器中充入3mol
;某温度下,向2L恒容密闭容器中充入3mol  和3mol
和3mol  发生反应,各物质的量变化如下表;
发生反应,各物质的量变化如下表;
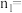
_______ mol,0~ 时刻用
时刻用 表示反应(ⅰ)的平均反应速率为
表示反应(ⅰ)的平均反应速率为_______ mol/(L·min)(用含 的式子表示),该温度下反应(ⅰ)的平衡常数为
的式子表示),该温度下反应(ⅰ)的平衡常数为_______ 。
(4)科学家研究发现在一种特殊催化剂作用下,水可促进 、
、 高选择性的直接合成
高选择性的直接合成 ,其中部分反应机理如图所示。
,其中部分反应机理如图所示。 在
在 氧化合成甲醇过程中的作用是
氧化合成甲醇过程中的作用是_______ ,决定反应进行的最大能垒(活化能)为_______ kJ/mol,该步骤的化学方程式为_______ ;在催化剂表面, 和
和 更容易被吸附的是
更容易被吸附的是_______ 。
(1)
 可用于消除氮氧化物,反应原理如下:
可用于消除氮氧化物,反应原理如下: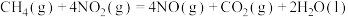
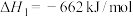
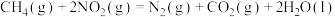
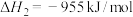


(2)
 可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ)
可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ) ,(ⅱ)
,(ⅱ)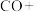
 ,过程中可能发生的副反应为
,过程中可能发生的副反应为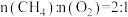 进行反应(ⅰ),各物质的量随时间变化如图,其中表示
进行反应(ⅰ),各物质的量随时间变化如图,其中表示 和CO的曲线分别为
和CO的曲线分别为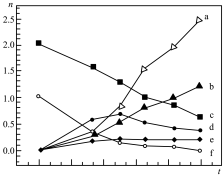
 ,(ⅱ)
,(ⅱ)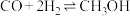 ;某温度下,向2L恒容密闭容器中充入3mol
;某温度下,向2L恒容密闭容器中充入3mol  和3mol
和3mol  发生反应,各物质的量变化如下表;
发生反应,各物质的量变化如下表;t/min n/mol | 0 |  |  |  | 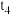 |
 | 3 | 2 | 1.5 | 0.5 | |
 | 3 | 2 | 1.5 | 0.5 | |
| CO | 0 | 3 | |||
 | 0 | 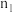 | 0.5 | 1 | |
 | 0 | 0.75 | 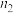 | 2 |
 时刻用
时刻用 表示反应(ⅰ)的平均反应速率为
表示反应(ⅰ)的平均反应速率为 的式子表示),该温度下反应(ⅰ)的平衡常数为
的式子表示),该温度下反应(ⅰ)的平衡常数为(4)科学家研究发现在一种特殊催化剂作用下,水可促进
 、
、 高选择性的直接合成
高选择性的直接合成 ,其中部分反应机理如图所示。
,其中部分反应机理如图所示。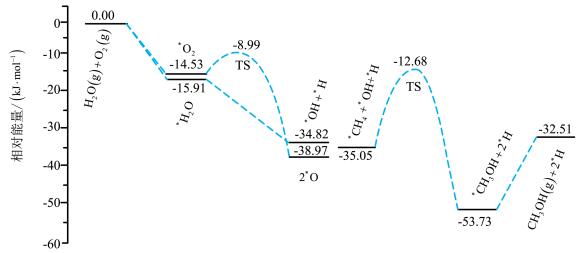
 在
在 氧化合成甲醇过程中的作用是
氧化合成甲醇过程中的作用是 和
和 更容易被吸附的是
更容易被吸附的是
您最近一年使用:0次
2023-02-24更新
|
477次组卷
|
4卷引用:湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题
湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题(已下线)预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)化学反应速率和化学平衡陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学
解题方法
3 . 氮元素在工业应用上有重要地位,回答下列问题:
(1)理论研究表明,在101 kPa和298K下,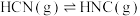 异构化反应的能量变化如图。
异构化反应的能量变化如图。
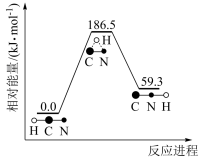
①稳定性:HCN_______ HNC(填“>”、“<”或“=”)。
②该异构化反应的△H=_______ 
(2)“长征2F”运载火箭使用N2O4和C2H8N2 (偏二甲册)作推进剂。12.0 g液态C2H8N2在液态N2O4中燃烧生成CO2、N2、H2O三种气体,放出510 kJ热量。该反应的热化学方程式为_______ 。
(3)科学家用氮气和氢气制备肼,过程如下:

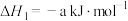
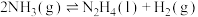
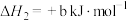
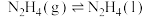
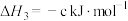
则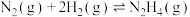 △H=
△H=_______ kJ/mol(用含a、b、c的计算式表示)
(1)理论研究表明,在101 kPa和298K下,
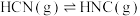 异构化反应的能量变化如图。
异构化反应的能量变化如图。
①稳定性:HCN
②该异构化反应的△H=

(2)“长征2F”运载火箭使用N2O4和C2H8N2 (偏二甲册)作推进剂。12.0 g液态C2H8N2在液态N2O4中燃烧生成CO2、N2、H2O三种气体,放出510 kJ热量。该反应的热化学方程式为
(3)科学家用氮气和氢气制备肼,过程如下:

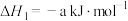
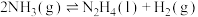
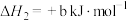
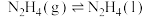
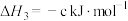
则
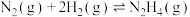 △H=
△H=
您最近一年使用:0次
4 . “千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ•mol-1)为
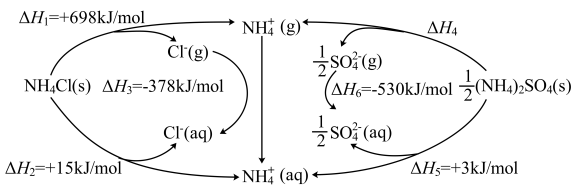
| A.+533 | B.+686 | C.+838 | D.+1143 |
您最近一年使用:0次
2023-02-22更新
|
5724次组卷
|
17卷引用:2022年重庆高考真题化学试题
2022年重庆高考真题化学试题(已下线)专题07 化学反应中的能量变化-2022年高考真题模拟题分项汇编(已下线)2022年重庆高考真题化学试题变式题(选择题11-14)山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题山东省安丘市第一中学2022-2023学年高三下学期4月月考化学试题(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题08 化学反应中的能量变化(已下线)专题08 化学反应中的能量变化(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)第23讲化学反应与热能(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省大同市第一中学校2023-2024学年高二上学期9月月考化学试题广东省深圳市翠园中学2023-2024学年高二上学期期中考试化学试题安徽省宣城中学2023-2024学年高二上学期12月月考化学试题09-2023新东方高二上期中考化学2024届黑龙江省齐齐哈尔市高三下学期联合考试模拟预测化学试题
解题方法
5 . 羰基硫是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。
(1)利用 和
和 制备羰基硫气体的反应原理为:
制备羰基硫气体的反应原理为: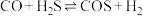 。
。
已知: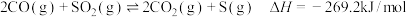
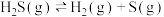
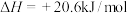
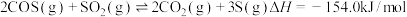
则反应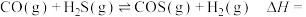
_______ 。
(2)在容积不变的密闭容器中,使 与
与 反应达到平衡。若反应前
反应达到平衡。若反应前 的物质的量为
的物质的量为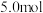 ,达到平衡时
,达到平衡时 的物质的量为
的物质的量为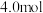 ,且化学平衡常数为0.1,则反应前
,且化学平衡常数为0.1,则反应前 的物质的量为
的物质的量为_______ mol。若保持温度不变,再向容器中加入 和
和 ,平衡移动的方向为
,平衡移动的方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(3)已知240℃时,反应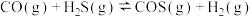 的平衡常教
的平衡常教 。在一密闭容器中,当进料浓度比
。在一密闭容器中,当进料浓度比 时,保持温度不变,反应达到平衡。
时,保持温度不变,反应达到平衡。
①240℃时,下列选项表明该反应一定达到平衡状态的是_______ (填标号)。
A.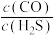 的值不再变化
的值不再变化
B.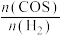 的值不再变化
的值不再变化
C.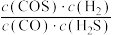 的值不再变化
的值不再变化
D.混合气体的平均相对分子质量不变
E.断裂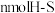 键的同时断裂
键的同时断裂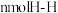 键
键
②由上述条件,经计算可得 的平衡转化率
的平衡转化率
_______ 。
③进一步提高反应速率,同时提高 平衡转化率的方法是
平衡转化率的方法是_______ 。
(1)利用
 和
和 制备羰基硫气体的反应原理为:
制备羰基硫气体的反应原理为: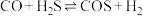 。
。已知:
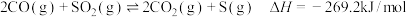
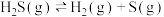
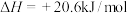
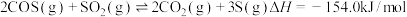
则反应
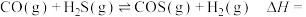
(2)在容积不变的密闭容器中,使
 与
与 反应达到平衡。若反应前
反应达到平衡。若反应前 的物质的量为
的物质的量为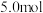 ,达到平衡时
,达到平衡时 的物质的量为
的物质的量为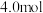 ,且化学平衡常数为0.1,则反应前
,且化学平衡常数为0.1,则反应前 的物质的量为
的物质的量为 和
和 ,平衡移动的方向为
,平衡移动的方向为(3)已知240℃时,反应
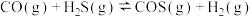 的平衡常教
的平衡常教 。在一密闭容器中,当进料浓度比
。在一密闭容器中,当进料浓度比 时,保持温度不变,反应达到平衡。
时,保持温度不变,反应达到平衡。①240℃时,下列选项表明该反应一定达到平衡状态的是
A.
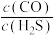 的值不再变化
的值不再变化 B.
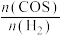 的值不再变化
的值不再变化C.
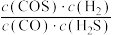 的值不再变化
的值不再变化 D.混合气体的平均相对分子质量不变
E.断裂
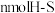 键的同时断裂
键的同时断裂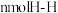 键
键②由上述条件,经计算可得
 的平衡转化率
的平衡转化率
③进一步提高反应速率,同时提高
 平衡转化率的方法是
平衡转化率的方法是
您最近一年使用:0次
6 . 将 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在催化剂作用下合成甲醇的主要反应如下:
在催化剂作用下合成甲醇的主要反应如下:
①
②
(1)反应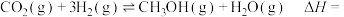
__________  .
.
(2)若反应②正反应的活化能为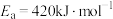 .则其逆反应的活化能
.则其逆反应的活化能
__________  .
.
(3) 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.________________ .
(4)在一体积为3 L的恒容密闭容器内充入 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。____________ (填“温度”或“压强”)。
②
______________ (填“>”、“<”或“=”,下同) ,反应速率
,反应速率
____________ 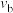 。
。
③a、b、c三点的平衡常数由大到小的顺序是____________ 。
④b点所处状态下的平衡常数
____________ 。
 转化为
转化为 等燃料是有效的减排手段.已知
等燃料是有效的减排手段.已知 与
与 在催化剂作用下合成甲醇的主要反应如下:
在催化剂作用下合成甲醇的主要反应如下:①

②

(1)反应
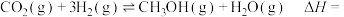
 .
.(2)若反应②正反应的活化能为
 .则其逆反应的活化能
.则其逆反应的活化能
 .
.(3)
 与
与 在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.
在催化剂表面上的部分反应历程如图,其中吸附在催化剂表面上的物种用·标注,Ts表示过渡态.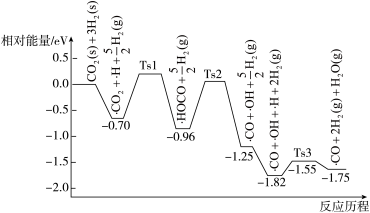
(4)在一体积为3 L的恒容密闭容器内充入
 和
和 发生反应
发生反应 .测得反应过程中
.测得反应过程中 的平衡转化率
的平衡转化率 与温度和压强的关系如图所示。
与温度和压强的关系如图所示。
②

 ,反应速率
,反应速率
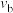 。
。③a、b、c三点的平衡常数由大到小的顺序是
④b点所处状态下的平衡常数

您最近一年使用:0次
解题方法
7 . 有机物A、B、C、D、E、F的转化关系如图。已知A的产量是衡量一个国家石油化工水平的标志,E具有浓郁香味,F常用于制造食物保鲜膜。回答下列问题:

(1)C中官能团的名称为______ ;A→F的反应类型为_____ 。
(2)写出B+D→E的化学方程式:_______ 。
(3)A→B的反应过程中的能量变化如图所示。

写出A→B总反应的热化学方程式:_______ 。
(4)交警对司机“酒驾”进行呼气检测的化学原理是:经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被B蒸气还原为+3价铬,颜色发生变化)判断司机是否饮酒,写出K2Cr2O7的酸性溶液与B反应生成D的离子方程式:______ 。
(5)研究发现,在酸性B燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示:
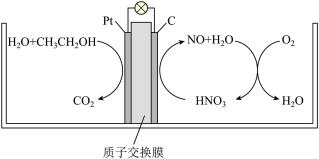
则硝酸的作用为______ ,负极电极反应式为______ 。

(1)C中官能团的名称为
(2)写出B+D→E的化学方程式:
(3)A→B的反应过程中的能量变化如图所示。

写出A→B总反应的热化学方程式:
(4)交警对司机“酒驾”进行呼气检测的化学原理是:经硫酸酸化处理的三氧化铬(CrO3)(与重铬酸钾原理类似)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中的+6价铬能被B蒸气还原为+3价铬,颜色发生变化)判断司机是否饮酒,写出K2Cr2O7的酸性溶液与B反应生成D的离子方程式:
(5)研究发现,在酸性B燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示:

则硝酸的作用为
您最近一年使用:0次
名校
8 . 回答下列问题
(1)在一定条件下,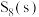 和
和 (g)发生反应依次转化为
(g)发生反应依次转化为 (g)和
(g)和 (g)。反应过程和能量关系可用如图简单表示(图中的
(g)。反应过程和能量关系可用如图简单表示(图中的 表示生成1mol产物的数据)
表示生成1mol产物的数据)

①写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。
②写出 分解生成
分解生成 和
和 的热化学方程式:
的热化学方程式:_______ 。
(2)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:
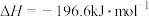
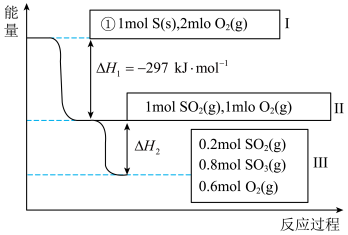
①写出能表示硫的燃烧热的热化学方程式:_______ 。
②
_______  。
。
(3) 焙烧产生的
焙烧产生的 可用于制硫酸。
可用于制硫酸。
已知25℃、101kPa时,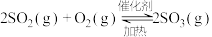
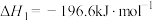
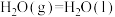
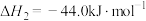 ;
;
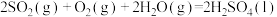
 ;
;
则 (g)与
(g)与 反应生成
反应生成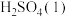 的热化学方程式是
的热化学方程式是_______ 。
(1)在一定条件下,
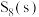 和
和 (g)发生反应依次转化为
(g)发生反应依次转化为 (g)和
(g)和 (g)。反应过程和能量关系可用如图简单表示(图中的
(g)。反应过程和能量关系可用如图简单表示(图中的 表示生成1mol产物的数据)
表示生成1mol产物的数据)
①写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:②写出
 分解生成
分解生成 和
和 的热化学方程式:
的热化学方程式:(2)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:

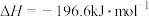

①写出能表示硫的燃烧热的热化学方程式:
②

 。
。(3)
 焙烧产生的
焙烧产生的 可用于制硫酸。
可用于制硫酸。已知25℃、101kPa时,
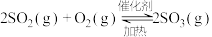
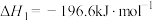
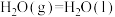
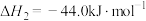 ;
;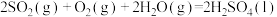
 ;
;则
 (g)与
(g)与 反应生成
反应生成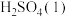 的热化学方程式是
的热化学方程式是
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.氢气和甲醇是人们开发和利用的新能源。
已知:①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1529.4kJ/mol
②25℃、101kPa时,2g氢气完全燃烧生成液态水,放出285.9kJ热量。
(1)写出氢气燃烧的热化学方程式_______ 。
(2)作为能源,氢气比甲醇更具有的优点_______ 、_______ (写出两点即可)。
Ⅱ.处理NO、N2O、NO2等含氮气体是环保热点之一。
(3)一定条件下发生反应:CO(g)+NO2(g)=CO2(g)+NO(g),其反应过程的能量变化如下图所示。

①该反应的ΔH=_______ ,若加入催化剂,ΔH将_______ (填“升高”“降低”或“不变”)。
②该反应中正反应活化能_______ (填“>”或“<”)逆反应活化能。
(4)已知:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=-632kJ/mol.写出NO2(g)和CO(g)反应生成无污染的两种气态产物的热化学方程式_______ 。
已知:①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1529.4kJ/mol
②25℃、101kPa时,2g氢气完全燃烧生成液态水,放出285.9kJ热量。
(1)写出氢气燃烧的热化学方程式
(2)作为能源,氢气比甲醇更具有的优点
Ⅱ.处理NO、N2O、NO2等含氮气体是环保热点之一。
(3)一定条件下发生反应:CO(g)+NO2(g)=CO2(g)+NO(g),其反应过程的能量变化如下图所示。

①该反应的ΔH=
②该反应中正反应活化能
(4)已知:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=-632kJ/mol.写出NO2(g)和CO(g)反应生成无污染的两种气态产物的热化学方程式
您最近一年使用:0次
2023-02-13更新
|
203次组卷
|
2卷引用:湖南省益阳市2020-2021学年高二上学期期末考试化学试题
解题方法
10 . 2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(1)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:
①
 kJ/mol
kJ/mol
②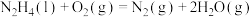
 kJ/mol
kJ/mol
请写出 与
与 反应的热化学方程式
反应的热化学方程式_______ 。此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_______ 。
③
 ,
, 与
与 进行大小比较:
进行大小比较:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)二甲醚( )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为: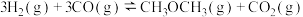
 kJ/mol。
kJ/mol。
①改变下列“量”,一定会引起 发生变化的是
发生变化的是_______ (填代号)。
a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中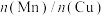 对合成二甲醚的影响情况如下图所示。
对合成二甲醚的影响情况如下图所示。
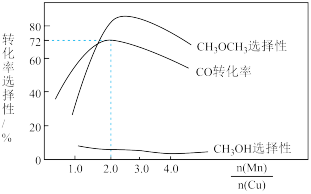
当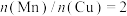 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性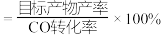 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为_______ 。(保留3位有效数字)
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ: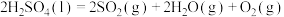
 kJ·mol
kJ·mol
反应Ⅱ:
 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为_______ kJ。
(1)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:①

 kJ/mol
kJ/mol②
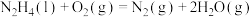
 kJ/mol
kJ/mol请写出
 与
与 反应的热化学方程式
反应的热化学方程式③

 ,
, 与
与 进行大小比较:
进行大小比较:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)二甲醚(
 )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为: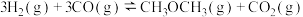
 kJ/mol。
kJ/mol。①改变下列“量”,一定会引起
 发生变化的是
发生变化的是a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中
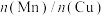 对合成二甲醚的影响情况如下图所示。
对合成二甲醚的影响情况如下图所示。
当
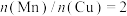 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性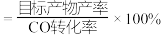 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:
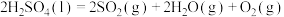
 kJ·mol
kJ·mol
反应Ⅱ:

 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L
 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
您最近一年使用:0次



