1 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入2mol 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有_______ (填数字序号)。
①容器中 、
、 、
、 共存
共存
②单位时间内生成2mol 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
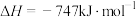 。
。
①已知该反应在不同条件下的化学反应速率如下:
a. b.
b.
c. d.
d.
上述4种情况反应速率最快的是_______ (填字母)
②实验测得反应
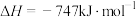 ,
,
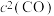 ,
,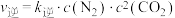 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。
达到平衡后,仅升高温度,平衡向_______ 移动(填“正反应方向”“逆反应方向”或“不”),
_______ (填“增大”“减小”或“不变”)。
(3)已知:
 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:

①
_______ 0(填“>”或“<”)。
②由图可知,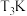 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是_______ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为_______ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入2mol
 和1mol
和1mol ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存
共存②单位时间内生成2mol
 的同时消耗2mol
的同时消耗2mol
③反应容器中压强不随时间变化
④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

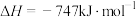 。
。①已知该反应在不同条件下的化学反应速率如下:
a.
 b.
b.
c.
 d.
d.
上述4种情况反应速率最快的是
②实验测得反应

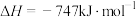 ,
,
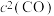 ,
,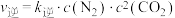 (
( 、
、 为速率常数,只与温度有关)。一定温度下达到平衡时
为速率常数,只与温度有关)。一定温度下达到平衡时 。
。达到平衡后,仅升高温度,平衡向

(3)已知:

 。将1mol CO和2mol
。将1mol CO和2mol 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,
 前反应中CO的转化率随温度升高而增大,原因是
前反应中CO的转化率随温度升高而增大,原因是③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
名校
解题方法
2 . I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
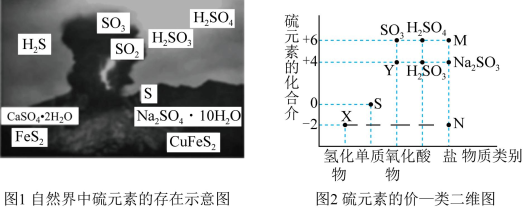
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次
解题方法
3 . 氨是人科学技术发史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
常温下,大气固氮的倾向_______ 工业固氮(填“大于”或“小于”)
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:_______ ;

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;

①前2分钟内的平均反应速率v(NH3)=_______ mol·L-1·min-1;
②有关工业固氮的说法正确的是_______ (选填序号) 。
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为_______ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 _______ (填化学式)
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
名校
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
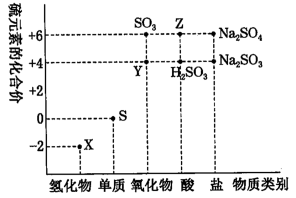
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) Z的浓溶液与铜单质在一定条件 下可以发生化学反应,该反应的化学方程式为___________ 。
(4) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析, 下列制备Na2S2O3的方案理论上可行的
是___________ (填字母)。
a.Na2S+S b. Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+ Na2SO4
(5) 2SO2(g) +O2(g) 2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
①0~2min时间段的化学反应速率为v(SO2)=___________ 。
②2min末c(O2)=___________ mol/L。
③关于2SO2(g) +O2(g) 2SO3(g)反应,下列说法正确的是
2SO3(g)反应,下列说法正确的是 ___________ 。
A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.通入过量的氧气可以实现SO2的完全转化

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3) Z的浓溶液与铜单质在一定条件 下可以发生化学反应,该反应的化学方程式为
(4) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析, 下列制备Na2S2O3的方案理论上可行的
是
a.Na2S+S b. Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+ Na2SO4
(5) 2SO2(g) +O2(g)
 2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。①0~2min时间段的化学反应速率为v(SO2)=
②2min末c(O2)=
③关于2SO2(g) +O2(g)
 2SO3(g)反应,下列说法正确的是
2SO3(g)反应,下列说法正确的是 A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.通入过量的氧气可以实现SO2的完全转化
您最近一年使用:0次
5 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知利用合成气(主要成分CO和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为___________ (填“放热”或“吸热”)反应。 反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:
反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应: ,体系中
,体系中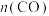 随时间的变化如表:
随时间的变化如表:
①0~2min内,以 表示的该反应速率
表示的该反应速率 =
=___________  ;
;
②下列措施不能提高反应速率的有___________ (请用相应字母填空);
a.升高温度 b.恒T、恒V下充入 c.及时分离出
c.及时分离出
d.恒T、恒P下充入 e.加入高效催化剂
e.加入高效催化剂
③下列叙述能说明反应达到平衡状态的是___________ (请用相应字母填空);
a.CO和 的浓度保持不变
的浓度保持不变
b.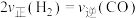
c.每生成1mol 的同时有2molH﹣H键形成
的同时有2molH﹣H键形成
d.容器内气体密度保持不变
e.容器内质量保持不变
(3)某兴趣小组为研究原电池原理,设计如图装置。___________ 极(填“正”或“负”);Al极发生的电极反应式为:___________ ,溶液中 移向
移向___________ 极(填“Cu”或“Al”);当负极金属溶解5.4g时,则理论上在标准状况下正极产生的气体体积为___________ L。
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。(1)已知利用合成气(主要成分CO和
 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为
 反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:
反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应: ,体系中
,体系中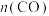 随时间的变化如表:
随时间的变化如表:| 时间(min) | 0 | 1 | 2 | 3 | 5 |
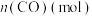 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
 表示的该反应速率
表示的该反应速率 =
= ;
;②下列措施不能提高反应速率的有
a.升高温度 b.恒T、恒V下充入
 c.及时分离出
c.及时分离出
d.恒T、恒P下充入
 e.加入高效催化剂
e.加入高效催化剂③下列叙述能说明反应达到平衡状态的是
a.CO和
 的浓度保持不变
的浓度保持不变 b.

c.每生成1mol
 的同时有2molH﹣H键形成
的同时有2molH﹣H键形成d.容器内气体密度保持不变
e.容器内质量保持不变
(3)某兴趣小组为研究原电池原理,设计如图装置。

 移向
移向
您最近一年使用:0次
名校
解题方法
6 . 甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂等。催化 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。
已知:① ;
;
② 。
。
回答下列问题:
(1)写出催化 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:___________ 。
(2)对于催化 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡___________ (填“向左”“向右”或“不”)移动;温度升高平衡常数___________ (填“变大”“变小”或“不变”)。
(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。

①a曲线表示___________ 。
②催化剂Ⅰ比催化剂Ⅱ催化效率___________ (填“高”“低”或“相同”),原因是___________ 。
(4)523K时,在1L恒容密闭容器中充入 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
反应从开始到20min时,以 浓度表示平均反应速率
浓度表示平均反应速率
___________ ;此温度下,压强平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
(5)一定条件下,在3个相同的密闭容器中分别充入 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
___________ ,原因是___________ 。

 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。已知:①
 ;
;②
 。
。回答下列问题:
(1)写出催化
 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:(2)对于催化
 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应
 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。
①a曲线表示
②催化剂Ⅰ比催化剂Ⅱ催化效率
(4)523K时,在1L恒容密闭容器中充入
 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
 浓度表示平均反应速率
浓度表示平均反应速率

 (保留三位有效数字)。
(保留三位有效数字)。(5)一定条件下,在3个相同的密闭容器中分别充入
 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的

您最近一年使用:0次
名校
解题方法
7 . 氨的用途十分泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为___________ kJ/mol。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是___________ (填选项序号)。
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向2L恒容密闭容器中充入0.4molN2、1.2molH2发生反应,NH3的浓度随时间变化情况如表所示:
0~10min内,用H2表示的平均反应速率为___________ ;实验测得体系平衡时的压强为10MPa,则该反应的平衡常数Kp=___________ MPa-2(用分数表示,Kp为分压表示的平衡常数,分压=总压×体积分数);若维持温度不变,向另一2L恒容密闭容器中充入H2、N2和NH3各4mol时,该反应的v正___________ (填“>”“<”或“=”)v逆。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A.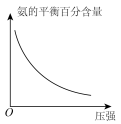 | B.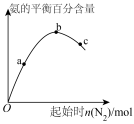 |
C.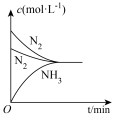 | D.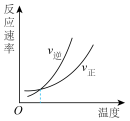 |
| 时间/min | 5 | 10 | 15 | 20 | 25 |
| 浓度/mol/L | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
您最近一年使用:0次
名校
8 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
(1)已知利用合成气(主要成分 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为_____________________ (填“放热”或“吸热”)反应。 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收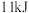 热量,请写出热化学方程式:
热量,请写出热化学方程式:_____________________________________________________ 。
(3)现在实验室中用 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,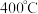 时发生反应:
时发生反应: ,体系中
,体系中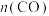 随时间的变化如表:
随时间的变化如表:
①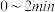 内,以
内,以 表示的该反应速率
表示的该反应速率
_____________________ 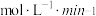 ;
;
②下列措施不能提高反应速率的有_____________________ (请用相应字母填空);
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂
③下列叙述能说明反应达到平衡状态的是_____________________ (请用相应字母填空);
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成
 容器内气体密度保持不变
容器内气体密度保持不变
 容器内质量保持不变
容器内质量保持不变
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。(1)已知利用合成气(主要成分
 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为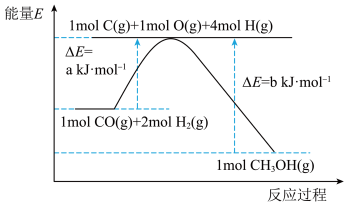
 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收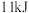 热量,请写出热化学方程式:
热量,请写出热化学方程式:(3)现在实验室中用
 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,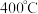 时发生反应:
时发生反应: ,体系中
,体系中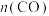 随时间的变化如表:
随时间的变化如表:时间 | 0 | 1 | 2 | 3 | 5 |
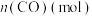 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
 内,以
内,以 表示的该反应速率
表示的该反应速率
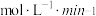 ;
;②下列措施不能提高反应速率的有
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂③下列叙述能说明反应达到平衡状态的是
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成 容器内气体密度保持不变
容器内气体密度保持不变 容器内质量保持不变
容器内质量保持不变
您最近一年使用:0次
解题方法
9 . 氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
(1)亚硝酰氯ClNO气体(结构式为Cl-N=O)是有机合成中的重要试剂,它可由Cl2和NO(化学键:N≡O)在常温常压条件下反应制得,已知几种化学键的键能数据如表所示:
则该反应的热化学方程式为___________ 。
(2)在合成氨的过程中,若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=___________ mol·L-1·min-1,H2的转化率为___________ 。
(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1___________ K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为___________ 。
(1)亚硝酰氯ClNO气体(结构式为Cl-N=O)是有机合成中的重要试剂,它可由Cl2和NO(化学键:N≡O)在常温常压条件下反应制得,已知几种化学键的键能数据如表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N≡O |
| 键能/(kJ/mol) | 243 | 200 | 607 | 630 |
(2)在合成氨的过程中,若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则5min内N2的平均反应速率v(N2)=(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近一年使用:0次
名校
10 . 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
(1)图中表示CH3OH的变化的曲线是_____ 。

(2)2s时正、逆反应速率大小:v(正)_____ v(逆)(填“>”“=”或“<”),用H2表示从0~2s内该反应的平均速率v(H2)=_____ 。
(3)下列措施能增大反应速率的是_____ (填字母)。
a.升高温度 b.扩大容器体积 c.充入一定量氦气 d.加入催化剂
(4)能说明该反应已达到平衡状态的是_____ 。
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
 CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)2s时正、逆反应速率大小:v(正)
(3)下列措施能增大反应速率的是
a.升高温度 b.扩大容器体积 c.充入一定量氦气 d.加入催化剂
(4)能说明该反应已达到平衡状态的是
a.反应中CO与CH3OH的物质的量之比为1:1
b.容器内压强保持不变
c.2v逆(CO)=v正(H2)
d.单位时间内每消耗1molCO,同时生成1molCH3OH
您最近一年使用:0次



