名校
1 . 下列在常温下能自发进行的反应,既能用焓判据解释又能用熵判据解释的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2022-01-05更新
|
87次组卷
|
2卷引用:湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题
2 . 从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5 (g)=4NO2 (g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵减的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-13更新
|
142次组卷
|
2卷引用:湖北省十堰市2016-2017学年高二上学期期末调研考试化学试题
解题方法
3 . 在某一恒压的密闭容器中,充入一定量的H2和CO2发生反应:
 。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
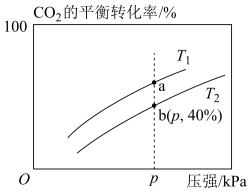
(1)经测得,每生成0.5molH2O(g)时,反应放出的热量为24.5kJ,则
_______ 。
(2)_______ (填“高温”或“低温”)有利于该反应自发进行,判断的理由是_______ 。
(3)判断平衡常数Ka与Kb的大小关系:Ka_______ Kb(填“<”、“>”或“=”)。
(4)在T2和p的条件下,往该容器中充入1.5molH2和0.5molCO2,该反应在第5min时达到平衡,此时容器的体积为2L。
①反应达到平衡时,c(CH3OH)=_______  ,H2O(g)的物质的量分数为
,H2O(g)的物质的量分数为_______ %。
②该反应在此温度下的平衡常数为_______ (保留两位有效数字)。
③反应达到平衡后,保持其他条件不变,再往该容器中充入0.1molH2和0.1molH2O(g),此时平衡_______ (填“向正反应方向”、“向逆反应方向”或“不”)移动。

 。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
。实验测得在不同温度下,反应体系中CO2的平衡转化率与压强的关系如图所示。回答下列问题:
(1)经测得,每生成0.5molH2O(g)时,反应放出的热量为24.5kJ,则

(2)
(3)判断平衡常数Ka与Kb的大小关系:Ka
(4)在T2和p的条件下,往该容器中充入1.5molH2和0.5molCO2,该反应在第5min时达到平衡,此时容器的体积为2L。
①反应达到平衡时,c(CH3OH)=
 ,H2O(g)的物质的量分数为
,H2O(g)的物质的量分数为②该反应在此温度下的平衡常数为
③反应达到平衡后,保持其他条件不变,再往该容器中充入0.1molH2和0.1molH2O(g),此时平衡
您最近一年使用:0次
解题方法
4 . “一饮涤昏寐,情来朗爽满天地。再饮清我神,忽如飞雨洒轻尘。三饮便得道,何须苦心破烦恼。”我国自古就有以茶待客的礼仪,下列化学方程式与泡茶到饮茶过程中的熵变、焓变以及自发性均一致的是
A.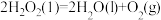 |
B.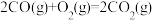 |
C.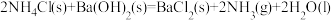 |
D.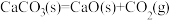 |
您最近一年使用:0次
2021-11-20更新
|
241次组卷
|
3卷引用:湖北省“荆、荆、襄、宜”四地七校联盟2021-2022学年上学期高三11月联考化学试题
解题方法
5 . I.实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制400mL0.10mol/LNaOH标准溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、___________ 。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
①量取待测溶液时,应用下图中的___________ (填“甲”或“乙”)量取。

②滴定达到终点的标志是___________ 。
③根据上述数据,可计算出该盐酸的浓度约为___________ (保留两位有效数字)。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有,___________ 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
II.某温度(T)下的溶液中,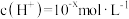 ,
,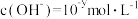 ,x与y的关系如图所示,请回答下列问题:
,x与y的关系如图所示,请回答下列问题:
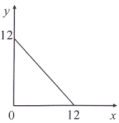
(3)此温度下,水的离子积Kw为______ ,则该温度T________ 25℃(填“>”“<”或“=”)。
(4)在此温度下,向 溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=______ ,实验②中由水电离产生的
___________  。
。
(5)在此温度下,将0.1 的
的 溶液与0.1
溶液与0.1 的
的 溶液按下表中甲、乙、丙、丁四种不同方式混合:
溶液按下表中甲、乙、丙、丁四种不同方式混合:
①按丁方式混合后,所得溶液显___________ (填“酸”“碱”或“中”)性。
②写出按乙方式混合反应的离子方程式:___________ 。
③按甲方式混合后所得溶液的pH为___________ 。
III.
(6)催化剂在一定条件下可直接光催化分解 ,发生反应:
,发生反应: ,该反应的
,该反应的
______ (填“>”或“<”,下同)0,
______ 0,在低温下,该反应_______ (填“能”或“不能”)自发进行。
(7)已知在100kPa、298K时石灰石分解反应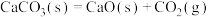 的△H>0、△S>0。
的△H>0、△S>0。
①常温下,该反应___________ (填“能”或“不能”自发进行。
②据本题反应数据分析温度___________ (填“能”或“不能”)成为反应进行方向的决定因素。
(1)配制400mL0.10mol/LNaOH标准溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 24.02 | 20.00 |
| 2 | 0.10 | 24.18 | 20.00 |
| 3 | 0.10 | 24.10 | 20.00 |

②滴定达到终点的标志是
③根据上述数据,可计算出该盐酸的浓度约为
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有,
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
II.某温度(T)下的溶液中,
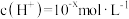 ,
,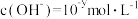 ,x与y的关系如图所示,请回答下列问题:
,x与y的关系如图所示,请回答下列问题:
(3)此温度下,水的离子积Kw为
(4)在此温度下,向
 溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |

 。
。(5)在此温度下,将0.1
 的
的 溶液与0.1
溶液与0.1 的
的 溶液按下表中甲、乙、丙、丁四种不同方式混合:
溶液按下表中甲、乙、丙、丁四种不同方式混合:| 甲 | 乙 | 丙 | 丁 | |
0.1  溶液体积/mL 溶液体积/mL | 10 | 10 | 10 | 10 |
0.1  溶液体积/mL 溶液体积/mL | 5 | 10 | 15 | 20 |
②写出按乙方式混合反应的离子方程式:
③按甲方式混合后所得溶液的pH为
III.
(6)催化剂在一定条件下可直接光催化分解
 ,发生反应:
,发生反应: ,该反应的
,该反应的

(7)已知在100kPa、298K时石灰石分解反应
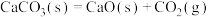 的△H>0、△S>0。
的△H>0、△S>0。①常温下,该反应
②据本题反应数据分析温度
您最近一年使用:0次
6 . 对于化学反应能否自发进行,下列说法错误的是
| A.需要加热才能够进行的反应肯定不是自发反应 |
B.若 , , ,则任何温度下都能自发进行 ,则任何温度下都能自发进行 |
C.若 , , ,则任何温度下都不能自发进行 ,则任何温度下都不能自发进行 |
| D.非自发反应在一定条件下可能变成自发反应 |
您最近一年使用:0次
名校
7 . 下列说法中正确的是
| A.若ΔH>0,ΔS<0,化学反应在任何温度下都能自发进行 |
| B.NH4Cl(s) =NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH<0 |
| C.2CaCO3(s)+2SO2(g)+O2(g) =2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH<0 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
您最近一年使用:0次
2021-11-11更新
|
208次组卷
|
2卷引用:湖北省“荆、荆、襄、宜四地七校考试联盟” 2021-2022学年高二上学期期中联考化学试题
8 . 一定温度下,某容积为1L的恒容密闭容器中通入2molSO2和1molO2,发生反应: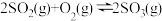
 (Q>0)。下列有关说法正确的是
(Q>0)。下列有关说法正确的是
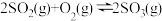
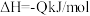 (Q>0)。下列有关说法正确的是
(Q>0)。下列有关说法正确的是| A.该反应在高温下才能自发进行 |
| B.充入少量He使体系压强增大,v正、v逆均不变 |
| C.若该反应的活化能为akJ/mol,则其逆反应的活化能为(Q-a)kJ/mol |
| D.当SO2和O2转化率相等时,该反应达到化学平衡状态 |
您最近一年使用:0次
2021-11-10更新
|
156次组卷
|
2卷引用:湖北省新高考联考协作体2021-2022学年高二上学期期中考试化学试题
9 . 下列关于焓变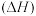 和熵变
和熵变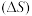 的说法正确的是
的说法正确的是
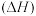 和熵变
和熵变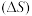 的说法正确的是
的说法正确的是A. 的反应一定能自发进行 的反应一定能自发进行 | B. 的反应一定能自发进行 的反应一定能自发进行 |
C.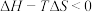 的反应能自发进行 的反应能自发进行 | D.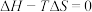 的反应一定没有进行 的反应一定没有进行 |
您最近一年使用:0次
2021-11-05更新
|
194次组卷
|
3卷引用:湖北省十堰市六校协作体2022-2023学年高二上学期10月月考化学试题
10 . 研究CO、CO2的转化既可减少碳排放,又可获得许多实用的含碳物质。回答下列问题:
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):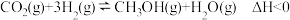 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
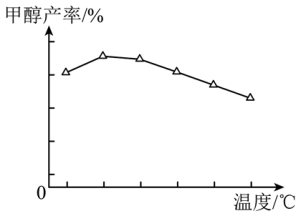
①该反应自发进行的条件是___________ (填“高温”“低温”或“任意温度”)。
②甲醇产率随温度升高先增大后减小的原因是___________ 。
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:
副反应:
一定条件下,向体积为V L的恒容密闭容器中投入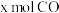 和
和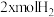 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=___________ 。
(3)我国科学家设计 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
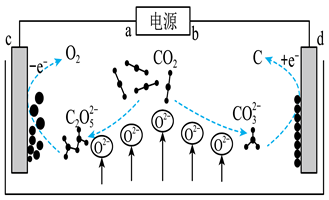
①d极的电极反应式为___________ 。
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上___________ (填“增加”或“减少”)了____ g。
(4)水煤气变换是重要的化工过程,反应为: 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为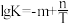 (m、n均为正数)。
(m、n均为正数)。
①水煤气变换是____ (填“吸热”或“放热”)反应。
②热力学温度为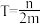 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则____ (填标号)。
A.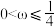 B.
B.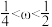 C.
C.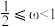
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):
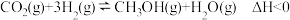 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
①该反应自发进行的条件是
②甲醇产率随温度升高先增大后减小的原因是
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:

副反应:

一定条件下,向体积为V L的恒容密闭容器中投入
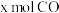 和
和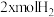 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=(3)我国科学家设计
 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
①d极的电极反应式为
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上
(4)水煤气变换是重要的化工过程,反应为:
 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为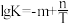 (m、n均为正数)。
(m、n均为正数)。①水煤气变换是
②热力学温度为
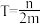 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则A.
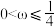 B.
B.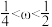 C.
C.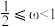
您最近一年使用:0次



