1 . 南京理工大学朱卫华等人基于单簇催化剂(SCC),提出了一种一氧化氮还原反应(NORR)的新型结构~活性关系,经研究发现主要反应如下:



在T₁℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2,发生上述反应,测得含氮元素占比[如N2的含氮元素占比 与时间的关系如图所示。
与时间的关系如图所示。



在T₁℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2,发生上述反应,测得含氮元素占比[如N2的含氮元素占比
 与时间的关系如图所示。
与时间的关系如图所示。
| A.曲线c表示的是氨气的含氮元素占比 |
| B.若选择对反应Ⅱ催化效果更好的催化剂,则 F点将移向 E点 |
| C.Ⅰ点时,0~45 min内用氨气表示的平均反应速率约为1kPa⋅min⁻¹ |
D.若95 min时达到平衡,则反应Ⅲ的平衡常数Kp的计算式为 |
您最近一年使用:0次
名校
2 . 我国科学工作者首次在实验室实现了二氧化碳到淀粉的人工合成,其合成路线中的第一步反应为CO2 g 3H2 g CH3OHg H2Og 。在不同温度T1、T2 T1<T2 条件下,在容积为2L的刚性容器中投入2 molCO2和6 molH2,发生上述反应,实验测得两容器中CO2或CH3OH 的物质的量随时间的变化关系如图所示。下列说法中错误的是
CH3OHg H2Og 。在不同温度T1、T2 T1<T2 条件下,在容积为2L的刚性容器中投入2 molCO2和6 molH2,发生上述反应,实验测得两容器中CO2或CH3OH 的物质的量随时间的变化关系如图所示。下列说法中错误的是
 CH3OHg H2Og 。在不同温度T1、T2 T1<T2 条件下,在容积为2L的刚性容器中投入2 molCO2和6 molH2,发生上述反应,实验测得两容器中CO2或CH3OH 的物质的量随时间的变化关系如图所示。下列说法中错误的是
CH3OHg H2Og 。在不同温度T1、T2 T1<T2 条件下,在容积为2L的刚性容器中投入2 molCO2和6 molH2,发生上述反应,实验测得两容器中CO2或CH3OH 的物质的量随时间的变化关系如图所示。下列说法中错误的是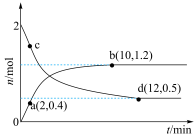
| A.ab 段用CH3OH 的表示平均反应速率为0.050mol L1 min1 |
| B.a 点时CO2的转化率为 20% |
| C.曲线 cd 对应T2 条件下的反应 |
| D.在同一温度条件下,当容器中混合气体的密度不随时间变化时,该反应达到平衡状态 |
您最近一年使用:0次
名校
3 . 在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。___________ 。平衡时H2的转化率为___________ 。
(2)下列措施能增大反应速率的是___________ (填字母)。
(3)下列描述中能说明上述反应达到平衡状态的是___________。
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收___________ kJ 的能量。
COg2H2g=CH3OHg,测得和 CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。

(2)下列措施能增大反应速率的是___________ (填字母)。
| A.升高温度 | B.降低压强 | C.减小 CH3OH 的浓度 | D.加入合适的催化剂 |
(3)下列描述中能说明上述反应达到平衡状态的是___________。
| A.CO、H2和CH3OH 三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗 2molH2 的同时生成 1molCH3OH |
(4)已知断开 1molCO(g)和 2molH2(g)中的化学键需要吸收的能量为 1924kJ,则断开 1mol CH3OH(g)中的化学键所需要吸收
您最近一年使用:0次
名校
解题方法
4 . 在2A g Bg 3Cg 4Dg 反应中,表示该反应速率最快的是
3Cg 4Dg 反应中,表示该反应速率最快的是
 3Cg 4Dg 反应中,表示该反应速率最快的是
3Cg 4Dg 反应中,表示该反应速率最快的是| A.vA 0.5mol L1 s1 | B.v B 0.3mol L1 s1 |
| C.v C 4.8mol L1 min1 | D.v D 1mol L1 s1 |
您最近一年使用:0次
解题方法
5 . 研究含碳和含氮物质的反应对生产、生活、科研等方面具有重要的意义。回答下列问题:
(1)已知:
ⅰ.
 kJ⋅mol
kJ⋅mol
ⅱ.
 kJ⋅mol
kJ⋅mol
ⅲ.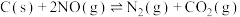
 kJ⋅mol
kJ⋅mol
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入___________ mol Ar作为稀释气(计算时不考虑其他反应)。
(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,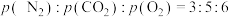 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。
① 的平均反应速率
的平均反应速率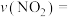
___________ mol⋅L ⋅min
⋅min 。
。
②下列说法正确的是___________ 。
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数
___________ [已知: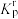 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。
(4)某科研小组以耐高温催化剂催化NO转化为 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是___________ 。
(1)已知:
ⅰ.

 kJ⋅mol
kJ⋅mol
ⅱ.

 kJ⋅mol
kJ⋅mol
ⅲ.
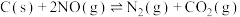
 kJ⋅mol
kJ⋅mol
则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)在保持T ℃、100 kPa条件下,向反应器中充入2 mol NO和1 mol
 发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入
发生反应ⅰ,平衡时转化率为50%,欲将平衡转化率降低至40%,需要向反应器中充入(3)一定条件下,向起始压强为90 kPa的2 L恒容密闭容器中通入2 mol NO和1 mol
 的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,
的混合气体,加入足量焦炭发生上述反应,5 min时反应达到平衡,测得体系总压强为84 kPa,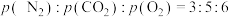 (p为气体分压,单位为kPa)。
(p为气体分压,单位为kPa)。①
 的平均反应速率
的平均反应速率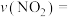
 ⋅min
⋅min 。
。②下列说法正确的是
A.将炭块粉碎可加快反应速率
B.平衡时充入Ar,反应ⅰ正向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡状态
③反应ⅰ的相对压力平衡常数

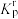 表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以
表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压除以 (
( kPa)]。
kPa)]。(4)某科研小组以耐高温催化剂催化NO转化为
 ,测得NO转化为
,测得NO转化为 的转化率随温度变化情况如图所示。则加入CO后,NO转化为
的转化率随温度变化情况如图所示。则加入CO后,NO转化为 的转化率增大的原因是
的转化率增大的原因是
您最近一年使用:0次
名校
6 . 探究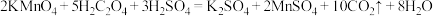 反应速率的影响因素,有关实验数据如下表所示:
反应速率的影响因素,有关实验数据如下表所示:
下列说法不正确的是
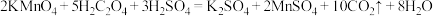 反应速率的影响因素,有关实验数据如下表所示:
反应速率的影响因素,有关实验数据如下表所示:| 编号 | 温度/℃ | 酸性 溶液 溶液 |  溶液 溶液 |  的体积 的体积(mL) |  溶液褪色平均时间/min 溶液褪色平均时间/min | ||
| 体积/mL | 浓度/( ) ) | 体积/mL | 浓度/( ) ) | ||||
| 1 | 25 | 4 | 0.1 | 8 | 0.2 | 8 | 12 |
| 2 | 80 | 2 | 0.1 | 8 | 0.2 | a | b |
| 3 | 25 | 2 | 0.1 | 8 | 0.2 | 10 | c |
| A.a=10,b<c,6<c<12 |
B.可通过比较收集相同体积的 所消耗的时间来判断反应速率的快慢 所消耗的时间来判断反应速率的快慢 |
C.用 表示该反应速率,v(实验1)为 表示该反应速率,v(实验1)为 |
D.实验时可依次向试管中加入酸性 溶液、 溶液、 溶液和水 溶液和水 |
您最近一年使用:0次
7 . 室温下,将 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: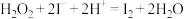 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。
回答下列问题:
(1)反应B的离子方程式是______ 。 的作用为
的作用为______ 。
(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
①实验Ⅰ中,若2s时 的浓度变为
的浓度变为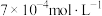 ,则0~2s时
,则0~2s时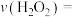
______ 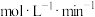
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则
______ ;实验Ⅲ和实验Ⅳ对照实验的目的为______ ;若探究温度对溶液颜色第一次变蓝快慢的影响因素,可选择实验______ 和实验______ (填写“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
 、
、 、KI、
、KI、 溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A:
溶液及淀粉混合,一段时间后溶液先变为蓝色,后蓝色褪去,且两种现象交替出现。反应分两步进行:反应A: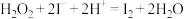 ;反应B:……;总反应为:
;反应B:……;总反应为: 。
。回答下列问题:
(1)反应B的离子方程式是
 的作用为
的作用为(2)小组同学探究溶液颜色第一次变蓝快慢的影响因素,进行下列反应。
试剂用量(mL) 序号 | 温度 | 0.01 | 0.01 | 0.01 | 0.01 |
|
Ⅰ | 25℃ | 5 | 4 | 8 | 3 | 0 |
Ⅱ | 25℃ | 5 | 2 | x | y | z |
Ⅲ | 35℃ | 5 | 4 | 8 | 3 | 0 |
Ⅳ | 35℃ | 3 | 4 | 8 | 3 | 2 |
 的浓度变为
的浓度变为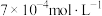 ,则0~2s时
,则0~2s时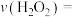
②为探究不同pH对溶液颜色第一次变蓝快慢的影响因素,进行实验Ⅰ和Ⅱ,则

您最近一年使用:0次
8 . T℃时,2L恒容密闭容器中A、B发生反应: ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
 ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是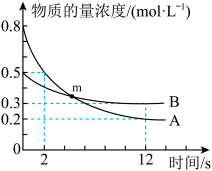
A. , , | B.0~12s,C的平均反应速率为0.05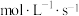 |
C.m点, | D.2s末时,D的物质的量浓度为0.2 |
您最近一年使用:0次
解题方法
9 . 利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.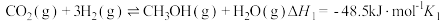
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。



(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为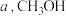 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数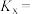
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为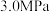 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气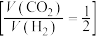 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为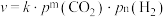 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,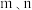 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则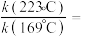
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
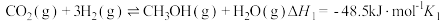
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。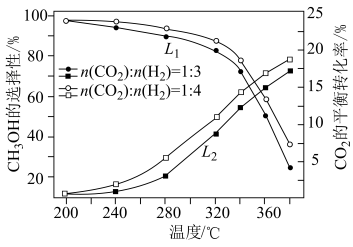
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是

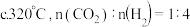

(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为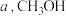 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数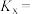
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
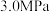 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气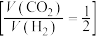 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
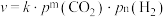 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,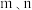 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则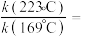
您最近一年使用:0次
解题方法
10 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: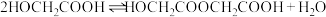
n聚: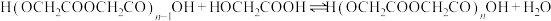
 聚:
聚: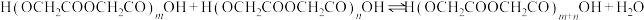 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1) 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中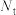 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,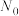 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则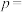
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
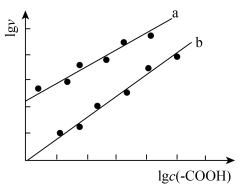
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为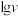 与
与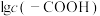 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.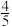 D.
D.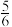
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
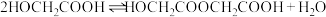
n聚:
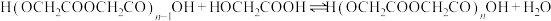
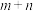 聚:
聚: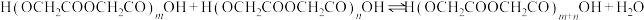 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中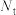 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,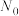 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则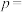
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为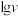 与
与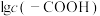 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.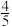 D.
D.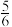
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次



