解题方法
1 . I.含碳化合物甲烷、 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
Ⅱ.以氧化铟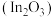 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。
已知:ⅰ.催化剂活化: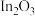 (无活性)
(无活性) (有活性);
(有活性);
ⅱ. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
反应①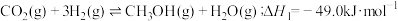
反应②
反应③: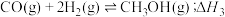
(2)反应③中
___________ 。
(3)工业上以原料气通过催化剂表面的方法生产甲醇, 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:___________ 。为了减少催化剂的失活,可以采用的方法是___________ 。
(4)按 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在t=250℃条件下的
,在t=250℃条件下的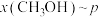 、在
、在 条件下的
条件下的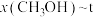 (温度)如图所示。
(温度)如图所示。___________ (填“a”或“b”),判断理由是___________ 。
ii.A、B、C、D、E、F中可能表示220℃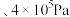 时的平衡状态的点是
时的平衡状态的点是___________ 。
(5)将 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
反应①的速率可表示为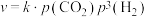 (
( 为常数),平衡时
为常数),平衡时 ,已知在
,已知在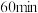 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在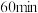 时的
时的
___________ (用含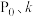 的式子表示)。
的式子表示)。
 等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:
等是重要的化工原料,可生产氢气、甲醇、烯烃等物质。回答下列问题:(1)一种甲烷催化氧化的反应历程如图所示,“*”表示微粒吸附在催化剂表面。下列叙述错误的是___________(填标号)。
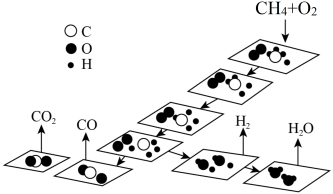
A.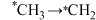 的过程中,放出能量 的过程中,放出能量 |
| B.产物从催化剂表面脱附的速率慢会降低总反应速率 |
C.适当提高 分压会降低 分压会降低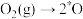 的反应速率 的反应速率 |
D. 与 与 反应生成 反应生成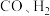 均涉及极性键、非极性键的断裂和生成 均涉及极性键、非极性键的断裂和生成 |
Ⅱ.以氧化铟
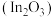 作催化剂,可实现
作催化剂,可实现 催化加氢制甲醇。
催化加氢制甲醇。已知:ⅰ.催化剂活化:
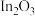 (无活性)
(无活性)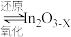 (有活性);
(有活性);ⅱ.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:反应①
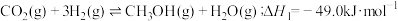
反应②

反应③:
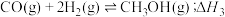
(2)反应③中

(3)工业上以原料气通过催化剂表面的方法生产甲醇,
 是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:
是造成催化剂失活的重要原因,请用化学方程式表示催化剂失活的原因:(4)按
 时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时只发生反应①,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在t=250℃条件下的
,在t=250℃条件下的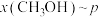 、在
、在 条件下的
条件下的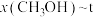 (温度)如图所示。
(温度)如图所示。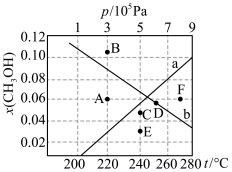
ii.A、B、C、D、E、F中可能表示220℃
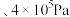 时的平衡状态的点是
时的平衡状态的点是(5)将
 和
和 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:
按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下只发生反应①和反应②。230℃时,容器内压强随时间的变化如下表所示:| 时间/min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa |  | 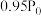 | 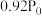 |  |  |
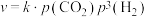 (
( 为常数),平衡时
为常数),平衡时 ,已知在
,已知在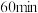 时
时 的转化率为
的转化率为 ,则反应①的正向反应在
,则反应①的正向反应在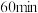 时的
时的
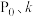 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
2 . 回答下列问题
(1)制玻璃的原材料是石英、纯碱和大理石,写出碳酸钠在玻璃熔炉中反应的化学方程式为___________ 。建筑装饰中常在玻璃上雕刻图案或花纹,用于刻蚀玻璃的化学试剂是___________ (填化学式)。往Na2SiO3溶液中通入足量CO2气体发生的化学方程式为:___________ 。用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作___________ 。
(2)① 是一种无色气体,在空气中能发生爆炸性自燃生成固态
是一种无色气体,在空气中能发生爆炸性自燃生成固态 和液态
和液态 。已知室温下
。已知室温下 自燃放出热量713.5kJ。写出室温下
自燃放出热量713.5kJ。写出室温下 自燃的热化学方程式
自燃的热化学方程式___________ 。
②在25℃、101kPa下,一定质量的无水乙醇(C2H6O)完全燃烧时放出热量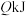 ,燃烧生成的
,燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得 沉淀,则在此条件下,1mol乙醇的燃烧热方程式为:
沉淀,则在此条件下,1mol乙醇的燃烧热方程式为:___________ 。
(3)某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。
①由图中所给数据进行分析,该反应的化学方程式为___________ 。
②反应从开始至2min,用Z的浓度变化表示的平均反应速率v(Z)=___________ 。
(1)制玻璃的原材料是石英、纯碱和大理石,写出碳酸钠在玻璃熔炉中反应的化学方程式为
(2)①
 是一种无色气体,在空气中能发生爆炸性自燃生成固态
是一种无色气体,在空气中能发生爆炸性自燃生成固态 和液态
和液态 。已知室温下
。已知室温下 自燃放出热量713.5kJ。写出室温下
自燃放出热量713.5kJ。写出室温下 自燃的热化学方程式
自燃的热化学方程式②在25℃、101kPa下,一定质量的无水乙醇(C2H6O)完全燃烧时放出热量
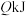 ,燃烧生成的
,燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得 沉淀,则在此条件下,1mol乙醇的燃烧热方程式为:
沉淀,则在此条件下,1mol乙醇的燃烧热方程式为:(3)某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。

①由图中所给数据进行分析,该反应的化学方程式为
②反应从开始至2min,用Z的浓度变化表示的平均反应速率v(Z)=
您最近一年使用:0次
3 .  储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,其原理:
,其原理: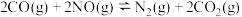
 。
。
(1)已知:① ;②
;②
 用含
用含 和
和 的代数式表示
的代数式表示
________ 。
(2)NSR反应机理及相对能量如图(TS表示过渡态):

反应过程中,速率最慢步骤的热化学方程式为________ 。
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如图1所示。

①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线________ (填“a”或“b”)。
②曲线b中前10min内CO的平均反应进率v(CO)=________ ,此温度下该反应的平衡常数K=________ 。
③在一恒温恒容的密闭容器中发生反应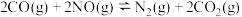 ,下列说法不能说明该反应达到化学平衡状态的是
,下列说法不能说明该反应达到化学平衡状态的是________ (填字母)。
aA.体系的压强保持不变 B.混合气体的密度保持不变
C. D.
D. 的浓度保持不变
的浓度保持不变
④若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点________ (填“A、B、C、D或E”)。
(4) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图2可知工业使用的最佳催化剂和相应的温度分别为
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图2可知工业使用的最佳催化剂和相应的温度分别为________ 、________ 。
 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,其原理:
,其原理: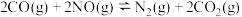
 。
。(1)已知:①
 ;②
;②
 用含
用含 和
和 的代数式表示
的代数式表示
(2)NSR反应机理及相对能量如图(TS表示过渡态):

反应过程中,速率最慢步骤的热化学方程式为
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如图1所示。

①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线
②曲线b中前10min内CO的平均反应进率v(CO)=
③在一恒温恒容的密闭容器中发生反应
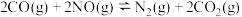 ,下列说法不能说明该反应达到化学平衡状态的是
,下列说法不能说明该反应达到化学平衡状态的是aA.体系的压强保持不变 B.混合气体的密度保持不变
C.
 D.
D. 的浓度保持不变
的浓度保持不变④若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点
(4)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图2可知工业使用的最佳催化剂和相应的温度分别为
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图2可知工业使用的最佳催化剂和相应的温度分别为
您最近一年使用:0次
4 .  甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
主反应:

副反应:
 ,
,
回答下列问题:
(1)向 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
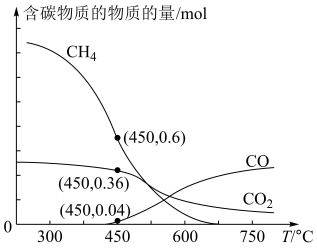
①工业上,常选用 作为合成温度,原因是
作为合成温度,原因是__________ 。
② 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为______  ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性=________ 。(已知:选择性 )
)
(2)在体积相等的多个恒容密闭容器中,分别充入 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为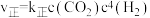 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得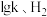 转化率与温度关系如图所示。
转化率与温度关系如图所示。
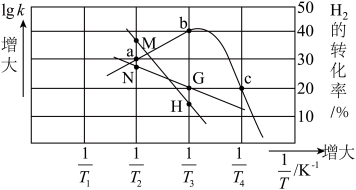
①c点______ (填“达平衡”或“未平衡”)。
②主反应活化能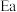 (正)
(正)___ 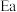 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表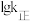 的曲线是
的曲线是______ (填“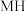 ”或“
”或“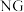 ”)。
”)。
③ 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
________ (列出计算式)。
(3)生物电化学系统可实现 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物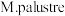 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式________ 。
 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:主反应:


副反应:

 ,
,回答下列问题:
(1)向
 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
①工业上,常选用
 作为合成温度,原因是
作为合成温度,原因是②
 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为 ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性= )
)(2)在体积相等的多个恒容密闭容器中,分别充入
 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为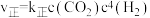 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得 转化率与温度关系如图所示。
转化率与温度关系如图所示。
①c点
②主反应活化能
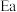 (正)
(正)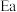 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表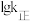 的曲线是
的曲线是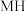 ”或“
”或“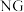 ”)。
”)。③
 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
(3)生物电化学系统可实现
 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物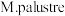 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
您最近一年使用:0次
解题方法
5 . 在容积为 的密闭容器中,进行如下反应:
的密闭容器中,进行如下反应: ,最初加入
,最初加入 和
和 ,在不同温度下,D的物质的量
,在不同温度下,D的物质的量 和时间t的关系如图。试回答下列问题:
和时间t的关系如图。试回答下列问题:
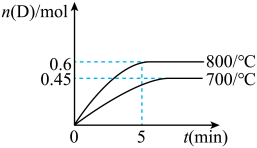
(1) 时,
时, 内,以B表示的平均反应速率为
内,以B表示的平均反应速率为___________ 。
(2)能判断该反应达到化学平衡状态的依据有___________ 。
a.容器中压强不变 b.混合气体中 不变
不变
c. d.
d.
(3)利用图中数据计算: 时A物质的平衡转化率为
时A物质的平衡转化率为___________ , 时的平衡常数
时的平衡常数
___________  ,该反应为
,该反应为___________ 反应(填“吸热”或“放热”)。
(4)下列措施既能提高反应物A(g)的平衡转化率,又能增大反应速率的是___________ (填标号)
a.升高温度 b.恒容条件充入氩气
c.加入催化剂 d.增大初始投料比
(5) 时,某时刻测得体系中各物质的量如下:
时,某时刻测得体系中各物质的量如下: ,则此时该反应
,则此时该反应___________ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
 的密闭容器中,进行如下反应:
的密闭容器中,进行如下反应: ,最初加入
,最初加入 和
和 ,在不同温度下,D的物质的量
,在不同温度下,D的物质的量 和时间t的关系如图。试回答下列问题:
和时间t的关系如图。试回答下列问题:
(1)
 时,
时, 内,以B表示的平均反应速率为
内,以B表示的平均反应速率为(2)能判断该反应达到化学平衡状态的依据有
a.容器中压强不变 b.混合气体中
 不变
不变c.
 d.
d.
(3)利用图中数据计算:
 时A物质的平衡转化率为
时A物质的平衡转化率为 时的平衡常数
时的平衡常数
 ,该反应为
,该反应为(4)下列措施既能提高反应物A(g)的平衡转化率,又能增大反应速率的是
a.升高温度 b.恒容条件充入氩气
c.加入催化剂 d.增大初始投料比

(5)
 时,某时刻测得体系中各物质的量如下:
时,某时刻测得体系中各物质的量如下: ,则此时该反应
,则此时该反应
您最近一年使用:0次
6 . 甲醇是重要的化工原料。利用合成气(主要成分为CO、 和
和 )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
Ⅰ.

Ⅱ.

(1)在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
①
__________ 0,其理由是__________ 。
②能判断该反应达到化学平衡状态的依据是__________ 。
A. B.容器内
B.容器内 的体积分数保持不变
的体积分数保持不变
C.容器内气体密度保持不变 D.容器中压强保持不变
③若1200℃时,在某时刻平衡体系中 、
、 、CO(g)、
、CO(g)、 的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时
的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时
__________  (填大于、小于或等于),其理由是
(填大于、小于或等于),其理由是__________ 。
(2)某温度时在另一2L的恒容密闭容器中进行反应Ⅱ,若开始时通入CO1mol, 2mol,5min时反应达到平衡,测得平衡时CO的转化率为60%,平衡时总压强为PkPa.
2mol,5min时反应达到平衡,测得平衡时CO的转化率为60%,平衡时总压强为PkPa.
①0-5min,用CO表示的化学反应速率为__________ 。
②平衡时, 所占的物质的量分数为
所占的物质的量分数为__________ 。
 和
和 )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:Ⅰ.


Ⅱ.


(1)在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

②能判断该反应达到化学平衡状态的依据是
A.
 B.容器内
B.容器内 的体积分数保持不变
的体积分数保持不变C.容器内气体密度保持不变 D.容器中压强保持不变
③若1200℃时,在某时刻平衡体系中
 、
、 、CO(g)、
、CO(g)、 的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时
的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,此时
 (填大于、小于或等于),其理由是
(填大于、小于或等于),其理由是(2)某温度时在另一2L的恒容密闭容器中进行反应Ⅱ,若开始时通入CO1mol,
 2mol,5min时反应达到平衡,测得平衡时CO的转化率为60%,平衡时总压强为PkPa.
2mol,5min时反应达到平衡,测得平衡时CO的转化率为60%,平衡时总压强为PkPa.①0-5min,用CO表示的化学反应速率为
②平衡时,
 所占的物质的量分数为
所占的物质的量分数为
您最近一年使用:0次
名校
7 . 运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机有重要意义。
Ⅰ.已知: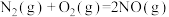 ∆H=akJ·mol
∆H=akJ·mol K1
K1
 ∆H=bkJ·mol
∆H=bkJ·mol K2
K2
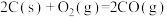 ∆H=ckJ·mol
∆H=ckJ·mol K3
K3
(1)写出CO还原NO反应的热化学方程式______ (∆H用含a、b、c表达式表示),并写出该反应的平衡常数表达式______ (用)K1、K2、K3表示)。
Ⅱ.用H2还原CO2在一定条件下合成CH3OH; ∆H<0
∆H<0
(2)某温度下,在恒容密闭容器中发生可逆反应 ,下列说法中能说明该反应达到化学平衡状态的是______(填字母序号)。
,下列说法中能说明该反应达到化学平衡状态的是______(填字母序号)。
(3)T1℃下,在2 L恒容密闭容器中充入2 mol CO2和6 mol H2合成CH3OH(g),测得5分钟后反应达平衡,平衡后压强是初始压强的 ,求v(H2)=
,求v(H2)= ______ 。
(4)用 还原CO2合成CH3OH反应中在起始物
还原CO2合成CH3OH反应中在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在 Pa时x(CH3OH)随温度(T)的变化,如图所示。
Pa时x(CH3OH)随温度(T)的变化,如图所示。
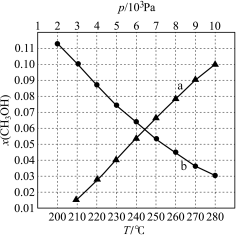
①图中对应等压过程的曲线是______ (填“a”或“b”),判断的理由是____________ 。
②恒温时(T=250℃),x(CH3OH)=0.1时,CO2的平衡转化率
______ (保留小数点后一位),此条件下该反应的Kp=______ Pa-2(保留小数点后一位)(分压=总压×物质的量分数)。
Ⅰ.已知:
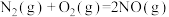 ∆H=akJ·mol
∆H=akJ·mol K1
K1 ∆H=bkJ·mol
∆H=bkJ·mol K2
K2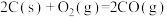 ∆H=ckJ·mol
∆H=ckJ·mol K3
K3(1)写出CO还原NO反应的热化学方程式
Ⅱ.用H2还原CO2在一定条件下合成CH3OH;
 ∆H<0
∆H<0(2)某温度下,在恒容密闭容器中发生可逆反应
 ,下列说法中能说明该反应达到化学平衡状态的是______(填字母序号)。
,下列说法中能说明该反应达到化学平衡状态的是______(填字母序号)。| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
| C.体系的压强不再发生变化 |
| D. CO2、H2、CH3OH的物质的量之比为1∶2∶1 |
(3)T1℃下,在2 L恒容密闭容器中充入2 mol CO2和6 mol H2合成CH3OH(g),测得5分钟后反应达平衡,平衡后压强是初始压强的
 ,求v(H2)=
,求v(H2)= (4)用
 还原CO2合成CH3OH反应中在起始物
还原CO2合成CH3OH反应中在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在 Pa时x(CH3OH)随温度(T)的变化,如图所示。
Pa时x(CH3OH)随温度(T)的变化,如图所示。
①图中对应等压过程的曲线是
②恒温时(T=250℃),x(CH3OH)=0.1时,CO2的平衡转化率

您最近一年使用:0次
8 . 2023年9月23日晚,随着亚运会主火炬的点燃,第19届亚运会在杭州正式开幕。开幕式主火炬燃料创新使用零碳甲醇燃料,彰显了中国打造碳中和亚运会的成果。
I.甲醇作为火炬燃料亮相世界,为甲醇产业迎来了高光时刻,甲醇技术路线有望成为中国绿色能源重要组成部分。
目前,工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:
反应Ⅱ: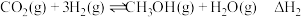
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)
(1)在一定条件下将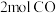 和
和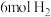 充入
充入 的密闭容器中发生反应Ⅰ,5分钟后达到平衡,测得
的密闭容器中发生反应Ⅰ,5分钟后达到平衡,测得 ,此段时间的反应速率(用
,此段时间的反应速率(用 表示)为
表示)为___________  。若此时再向容器中加入
。若此时再向容器中加入 、
、 、
、 各
各 ,则化学平衡
,则化学平衡___________ (填“正向”、“逆向”或“不”)移动。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是___________ 。
a.充入CO b.将 从体系中分离 c.升高温度 d.选用新型高效催化剂
从体系中分离 c.升高温度 d.选用新型高效催化剂
(3)一定温度下,在固定容积的密闭容器中发生反应Ⅱ,下列能判断反应达到平衡状态的是___________ 。
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变 d.消耗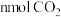 的同时生成
的同时生成
Ⅱ.近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨,二氧化碳加氢制甲醇为零碳甲醇的重要来源,在某 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
Ⅰ.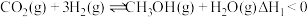
Ⅱ.
回答下列问题:
(4) 在催化剂作用下,将平均相对分子质量为16的
在催化剂作用下,将平均相对分子质量为16的 和
和 的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率v(正)
的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率v(正) (正)
(正)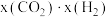 ,v(逆)
,v(逆) (逆)
(逆)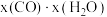 ,k(正)、k(逆)为速率常数,x为物质的量分数。
,k(正)、k(逆)为速率常数,x为物质的量分数。
①当 转化率达到
转化率达到 时,反应达到平衡状态,这时
时,反应达到平衡状态,这时 和
和 的平均相对分子质量为23,若反应Ⅱ的k(正)
的平均相对分子质量为23,若反应Ⅱ的k(正)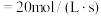 ,平衡时反应速率v(逆)
,平衡时反应速率v(逆)
___________ 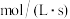 ;
;
②由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回16,原因是___________ 。
(5)其他条件相同时,反应温度对 选择性(转化为
选择性(转化为 的
的 在总转化量中的占比)的影响如图所示:
在总转化量中的占比)的影响如图所示:
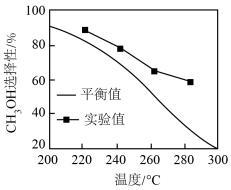
由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是___________ 。
I.甲醇作为火炬燃料亮相世界,为甲醇产业迎来了高光时刻,甲醇技术路线有望成为中国绿色能源重要组成部分。
目前,工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:

反应Ⅱ:
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)在一定条件下将
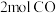 和
和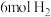 充入
充入 的密闭容器中发生反应Ⅰ,5分钟后达到平衡,测得
的密闭容器中发生反应Ⅰ,5分钟后达到平衡,测得 ,此段时间的反应速率(用
,此段时间的反应速率(用 表示)为
表示)为 。若此时再向容器中加入
。若此时再向容器中加入 、
、 、
、 各
各 ,则化学平衡
,则化学平衡(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是
a.充入CO b.将
 从体系中分离 c.升高温度 d.选用新型高效催化剂
从体系中分离 c.升高温度 d.选用新型高效催化剂(3)一定温度下,在固定容积的密闭容器中发生反应Ⅱ,下列能判断反应达到平衡状态的是
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变 d.消耗
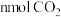 的同时生成
的同时生成
Ⅱ.近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨,二氧化碳加氢制甲醇为零碳甲醇的重要来源,在某
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:Ⅰ.
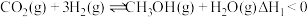
Ⅱ.

回答下列问题:
(4)
 在催化剂作用下,将平均相对分子质量为16的
在催化剂作用下,将平均相对分子质量为16的 和
和 的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率v(正)
的混合气体充入一恒容密闭容器中发生反应Ⅰ、Ⅱ,已知反应Ⅱ的反应速率v(正) (正)
(正)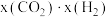 ,v(逆)
,v(逆) (逆)
(逆)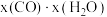 ,k(正)、k(逆)为速率常数,x为物质的量分数。
,k(正)、k(逆)为速率常数,x为物质的量分数。①当
 转化率达到
转化率达到 时,反应达到平衡状态,这时
时,反应达到平衡状态,这时 和
和 的平均相对分子质量为23,若反应Ⅱ的k(正)
的平均相对分子质量为23,若反应Ⅱ的k(正)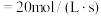 ,平衡时反应速率v(逆)
,平衡时反应速率v(逆)
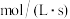 ;
;②由实验测得,随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回16,原因是
(5)其他条件相同时,反应温度对
 选择性(转化为
选择性(转化为 的
的 在总转化量中的占比)的影响如图所示:
在总转化量中的占比)的影响如图所示:
由图可知,温度相同时
 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.分别取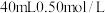 盐酸与
盐酸与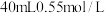 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为___________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是___________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】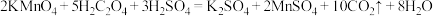
【实验内容及记录】
回答下列问题:
(3)根据上表中的实验数据,可以得到的结论是___________ 。
(4)利用实验3中数据计算,此条件下的反应速率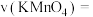
___________  。
。
(5)该小组同学根据经验绘制了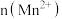 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中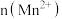 随时间变化的趋势应如图2所示。
随时间变化的趋势应如图2所示。
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设:生成的 对该反应有催化作用。
对该反应有催化作用。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③现象及结论:依据现象___________ ,得出该小组同学提出的假设成立。
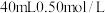 盐酸与
盐酸与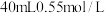 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中C.将盐酸错取为等浓度的醋酸
Ⅱ.某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】
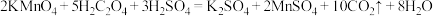
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量 | 室温下溶液褪色所需时间 | |||
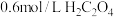 |  | 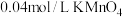 | 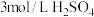 | ||
| 1 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 2.0 |
(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验3中数据计算,此条件下的反应速率
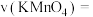
 。
。(5)该小组同学根据经验绘制了
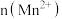 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中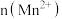 随时间变化的趋势应如图2所示。
随时间变化的趋势应如图2所示。
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设:生成的
 对该反应有催化作用。
对该反应有催化作用。②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入少量固体 | 室温下溶液褪色所需时间 | |||
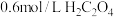 |  | 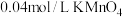 | 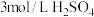 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | (填化学式) | t |
您最近一年使用:0次
名校
解题方法
10 . 在 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是
 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是A. | B. |
C. | D. |
您最近一年使用:0次



