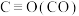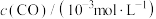1 . 氮氧化物( 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。
(1)反应 分为三步基元反应完成。
分为三步基元反应完成。
第一步: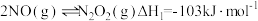 决速步骤)
决速步骤)
第二步: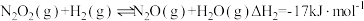
①活化能最高的是第___________ 步。
②为了提高总反应中NO的反应速率和转化率可采用的措施为___________ (写两条)。
(2)已知反应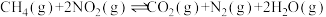 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入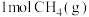 和
和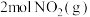 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
①用 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为___________ 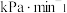 。
。
②该温度下的压强平衡常数
___________ kPa。
(3)NO催化分解ICl制取 和
和 的原理为:
的原理为:
反应I: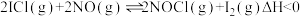 ;
;
反应Ⅱ: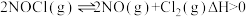 ;
; 。
。
反应的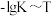 的关系如图所示。
的关系如图所示。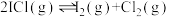 的
的
___________
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。 的电极反应式为
的电极反应式为___________ 。
②当电解电压为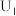 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。(1)反应
 分为三步基元反应完成。
分为三步基元反应完成。第一步:
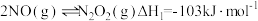 决速步骤)
决速步骤)第二步:
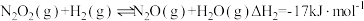
①活化能最高的是第
②为了提高总反应中NO的反应速率和转化率可采用的措施为
(2)已知反应
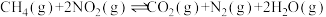 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入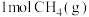 和
和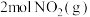 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
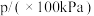 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为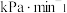 。
。②该温度下的压强平衡常数

(3)NO催化分解ICl制取
 和
和 的原理为:
的原理为:反应I:
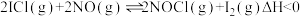 ;
;
反应Ⅱ:
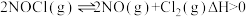 ;
; 。
。反应的
 的关系如图所示。
的关系如图所示。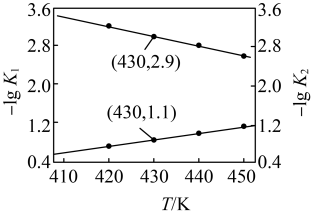
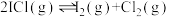 的
的
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为
 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
 的电极反应式为
的电极反应式为②当电解电压为
 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
2 . I.在恒温2L密闭容器中通入气体X并发生放热反应:2X(g) Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)______ 。
(2)图中c点对应的速率关系是v(正)______ v(逆)(填“>”或“<”或“=”);b曲线与a比改变的条件是______ 。
(3)反应进行到a点时放出的热量______ 反应进行到b点时放出的热量(填“>”或“<”或“=”)。
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。______ (计算保留2位有效数字)。
(5)能说明上述反应达到平衡状态的是______ (填字母)。
(6)平衡时CH3OH的体积分数为______ 。平衡混合气体中CO2(g)和H2(g)的质量之比是______ 。
(7)第3分钟时v正(CH3OH)______ 第9分钟时v逆(CH3OH)(填“>”“<”“=”或“无法比较”)。
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。______ 。
(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是______ 。
 Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
| A.升高温度 | B.加入适量X |
| C.增大压强 | D.及时分离出Y |
(2)图中c点对应的速率关系是v(正)
(3)反应进行到a点时放出的热量
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(5)能说明上述反应达到平衡状态的是
| A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点) |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内生成1molH2,同时生成1molCH3OH |
| D.混合气体的平均相对分子质量不随时间的变化而变化 |
(6)平衡时CH3OH的体积分数为
(7)第3分钟时v正(CH3OH)
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
您最近一年使用:0次
名校
3 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨CO2。该甲醇的制备反应及副反应如下:
ⅰ. (放热反应)
(放热反应)
ⅱ. (吸热反应)
(吸热反应)
(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
若CO2与足量H2发生反应转化为1molCO和水蒸气时吸收热量为42kJ,则
______ 。
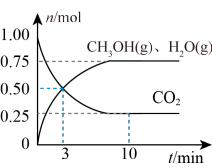
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:______ 。
②下列措施一定可以提高甲醇生成速率的是______ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是______ 。
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。______ 极,B极的电极反应式为____________ 。
ⅰ.
 (放热反应)
(放热反应)ⅱ.
 (吸热反应)
(吸热反应)(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
化学键 | H-O | C=O(CO2) | H-H |
|
键能/ | 462.8 | 803.0 | 436.0 | x |

(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
②下列措施一定可以提高甲醇生成速率的是
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

您最近一年使用:0次
4 . 一碳化学是化学反应过程中反应物只含一个碳原子的反应,一碳化学是从一碳氢化反应开始的,甲烷、一氧化碳是常见的一碳化学的原料。已知反应:
i.
ii.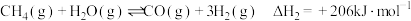
iii.
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为___________ ;反应i的正反应活化能为 ,则逆反应的活化能为
,则逆反应的活化能为___________  。
。
(2)向容积固定为 的密闭容器内充入
的密闭容器内充入 和
和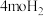 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
①从开始到 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
___________ 。
②反应达到平衡的时间段是___________ (填“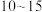 ”或“
”或“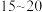 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
___________ 。
③平衡后,下列措施中能使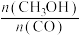 增大的有
增大的有___________ (填字母)。
a.升高温度 b.充入氦气 c.再充入 d.使用催化剂
d.使用催化剂
(3)电喷雾电离等方法得到的(
 、
、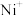 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线___________ (填“a”或“b”)。
②若 与
与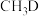 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有___________ 种。
i.

ii.
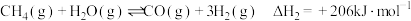
iii.

(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为
 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)向容积固定为
 的密闭容器内充入
的密闭容器内充入 和
和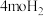 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:反应时间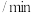 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强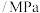 | p |  | 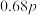 | x | 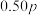 | 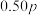 | 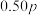 |
 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
②反应达到平衡的时间段是
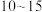 ”或“
”或“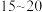 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
③平衡后,下列措施中能使
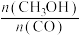 增大的有
增大的有a.升高温度 b.充入氦气 c.再充入
 d.使用催化剂
d.使用催化剂(3)电喷雾电离等方法得到的(

 、
、 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: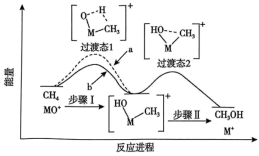
 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线②若
 与
与 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有
您最近一年使用:0次
名校
解题方法
5 . 氮的氧化物 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
(1) 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:__________ 。
(2)NO和 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,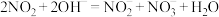 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若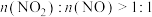 ,则会导致
,则会导致__________ ,若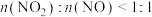 ,则会导致
,则会导致__________ 。
(3)在汽车尾气系统中,安装催化转化器可有效降低 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
①前2s的平均反应速率
____________ ,4s时NO的转化率为__________ 。
②若已知该反应的瞬时速率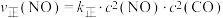 ,其中
,其中 为速率常数,
为速率常数,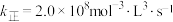 ,当NO的浓度变为原来的
,当NO的浓度变为原来的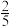 时,
时,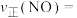
__________ 。
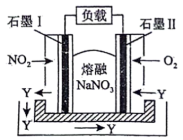
(4)由 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
①石墨Ⅱ电极为_____________ (填“正极”或“负极”)。
②写出石墨Ⅰ电极反应式_____________ 。
 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。(1)
 能形成酸雨,写出
能形成酸雨,写出 溶于水生成
溶于水生成 的化学方程式:
的化学方程式:(2)NO和
 可用NaOH溶液吸收,主要反应:
可用NaOH溶液吸收,主要反应: ,
,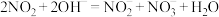 。将NO、
。将NO、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制NO和
。该工艺需控制NO和 物质的量之比接近1∶1.若
物质的量之比接近1∶1.若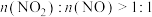 ,则会导致
,则会导致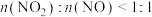 ,则会导致
,则会导致(3)在汽车尾气系统中,安装催化转化器可有效降低
 的排放。实验室为了模拟反应
的排放。实验室为了模拟反应 在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.00 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

②若已知该反应的瞬时速率
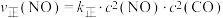 ,其中
,其中 为速率常数,
为速率常数,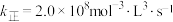 ,当NO的浓度变为原来的
,当NO的浓度变为原来的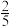 时,
时,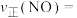
(4)由
 、
、 、熔融盐
、熔融盐 组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。
组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成氮的最高价氧化物Y。①石墨Ⅱ电极为
②写出石墨Ⅰ电极反应式
您最近一年使用:0次
名校
6 . 向容积均为 的恒容密闭容器M(恒温
的恒容密闭容器M(恒温 )、N(起始
)、N(起始 ,绝热)中分别加入
,绝热)中分别加入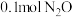 和
和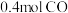 及相同催化剂发生反应:
及相同催化剂发生反应: 。实验测得两个容器中
。实验测得两个容器中 的物质的量随时间的变化关系如表所示。该反应的反应速率
的物质的量随时间的变化关系如表所示。该反应的反应速率 、
、 (
( 、
、 分别是正、逆反应的速率常数)。下列说法错误的是
分别是正、逆反应的速率常数)。下列说法错误的是
 的恒容密闭容器M(恒温
的恒容密闭容器M(恒温 )、N(起始
)、N(起始 ,绝热)中分别加入
,绝热)中分别加入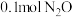 和
和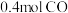 及相同催化剂发生反应:
及相同催化剂发生反应: 。实验测得两个容器中
。实验测得两个容器中 的物质的量随时间的变化关系如表所示。该反应的反应速率
的物质的量随时间的变化关系如表所示。该反应的反应速率 、
、 (
( 、
、 分别是正、逆反应的速率常数)。下列说法错误的是
分别是正、逆反应的速率常数)。下列说法错误的是| 时间/s | 0 | 100 | 200 | 300 | 400 |
容器①中 |  |  |  |  |  |
容器②中 |  |  |  |  |  |
| A.容器②表示容器N |
| B.该反应为放热反应 |
C.0~100s内,容器①中 的平均反应速率 的平均反应速率 |
D.当容器①中反应进行到 时 时 |
您最近一年使用:0次
名校
7 . 水煤气可以在一定条件下发生反应: ,现在向10L恒容密闭容器中充入
,现在向10L恒容密闭容器中充入 和
和 ,所得实验数据如表所示。下列说法错误的是
,所得实验数据如表所示。下列说法错误的是
 ,现在向10L恒容密闭容器中充入
,现在向10L恒容密闭容器中充入 和
和 ,所得实验数据如表所示。下列说法错误的是
,所得实验数据如表所示。下列说法错误的是实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
|
|
| ||
Ⅰ | 700 | 0.40 | 0.10 | 0.09 |
Ⅱ | 800 | 0.10 | 0.40 | 0.08 |
Ⅲ | 800 | 0.20 | 0.30 | a |
Ⅳ | 900 | 0.10 | 0.15 | b |
A. , , |
| B.降低温度,有利于提高CO的平衡转化率 |
C.实验Ⅰ中,若某时刻测得 ,则此时混合气体中 ,则此时混合气体中 的体积分数为10% 的体积分数为10% |
D.实验Ⅰ和Ⅲ中,反应均达到平衡时,平衡常数之比 |
您最近一年使用:0次
8 . 从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。回答下列问题:
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.
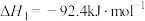
ⅱ.

ⅲ.

根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:__________ ;该反应自发进行的条件是__________ (填“高温”或“低温”)。
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:__________ (填“C”“ CaO/C”或“La2O3/C”),该情况下,A点__________ (填“是”或“不是”)平衡点。
②400℃时,CaO/C催化下反应速率v(NO)=__________ mol/(L·h)。
(3)臭氧脱硝存在如下两个反应:
a. ;
;
b. 。
。
T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
若起始压强为p0,T℃下反应达到平衡时,N2O4的分压与N2O5的分压相等,则O3的体积分数=__________ (保留两位有效数字),反应b平衡常数Kp=__________ (用含p0式子表示,Kp为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
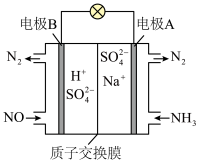
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为__________ 。
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.

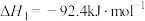
ⅱ.


ⅲ.


根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:

②400℃时,CaO/C催化下反应速率v(NO)=
(3)臭氧脱硝存在如下两个反应:
a.
 ;
;b.
 。
。T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
| t/h | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(NO2)/(mol/L) | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为
您最近一年使用:0次
9 . 草酸钙一水结晶水合物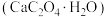 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
(1)在隔绝空气条件下,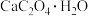 分解反应如下:
分解反应如下:
①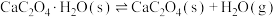
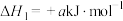 ;
;
②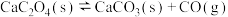
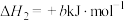 ;
;
③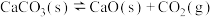
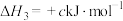 ;
;
④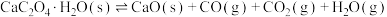

___________  (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。
(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=___________ 。
(3)已知反应②CaC2O4(s) CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=___________ 。(用e,b,c来表示)
(4)在密闭容器中充入足量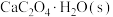 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:___________ 。
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:___________ 。
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为___________ 。
(6)氧化钙晶胞如图所示,已知: 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。___________ (填字母)。
A.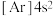 B.
B.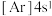 C.
C.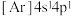 D.
D.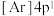
②氧化钙的摩尔体积为___________  。
。
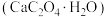 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:(1)在隔绝空气条件下,
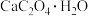 分解反应如下:
分解反应如下:①
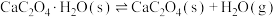
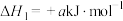 ;
;②
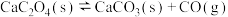
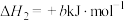 ;
;③
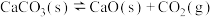
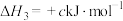 ;
;④
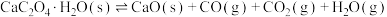

 (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s)
 CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=(3)已知反应②CaC2O4(s)
 CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=(4)在密闭容器中充入足量
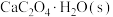 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示: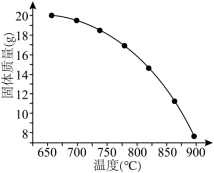
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为
(6)氧化钙晶胞如图所示,已知:
 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。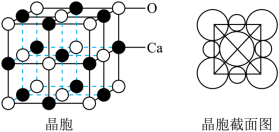
A.
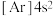 B.
B.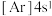 C.
C.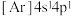 D.
D.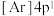
②氧化钙的摩尔体积为
 。
。
您最近一年使用:0次
2024·黑龙江·模拟预测
10 . 由γ-羟基丁酸生成γ-丁内酯的反应为HOCH2CH2CH2COOH
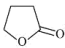 +H2O
+H2O  H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
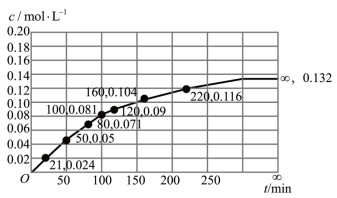
A.在50~80min内,以γ-丁内酯的浓度变化表示的反应速率为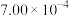 mol/(L⋅min) mol/(L⋅min) |
B.在25℃时,该反应的平衡常数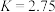 |
| C.加水降低γ-羟基丁酸的初始浓度,γ-羟基丁酸的平衡转化率减小 |
| D.使用非水溶剂并通过共沸回流移除体系中的水,有助于提高γ-丁内酯的平衡产率 |
您最近一年使用:0次