 常用于萃取稀土金属铌:
常用于萃取稀土金属铌:
 。某温度下,萃取过程中溶液中
。某温度下,萃取过程中溶液中 与时间的变化关系如图所示。下列叙述正确的是
与时间的变化关系如图所示。下列叙述正确的是
A.其他条件不变, 时萃取反应已停止 时萃取反应已停止 |
B. 增大,萃取反应平衡向左移动,平衡常数减小 增大,萃取反应平衡向左移动,平衡常数减小 |
C. min、 min、 min时萃取反应的正反应速率: min时萃取反应的正反应速率: |
D.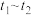 min内, min内,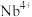 的平均反应速率 的平均反应速率 |
(1)工业上用CO2和H2反应合成二甲醚。
已知:

 ;
;
 。
。写出
 和
和 转化为
转化为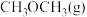 和
和 的热化学方程式:
的热化学方程式:(2)CO2催化加氢合成乙醇的反应原理为

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
②图1右图表示在总压为5MPa的恒压条件下,且m=3时,平衡状态下各物质的物质的量分数与温度的关系,则曲线d代表的物质为
(3)一种利用焦炉气中的H2和工业废气捕获的CO2生产绿色燃料甲醇的原理为
 、
、 。
。在研究该反应历程时发现,反应气中水蒸气含量会影响CH3OH的产率。为了研究水分子对该反应机制的内在影响,科学家利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响,如图3所示(吸附在催化剂表面上的物种用*标注)。
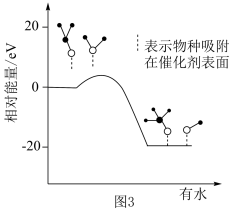
②资料显示:水也可以使催化剂活化点位减少。结合资料、上图及学过的知识推测,在反应气中添加水蒸气将如何影响甲醇产率及产生这种影响的原因:
(4)一定条件下,利用CO2和H2还可制得甲烷:
 ,主要副反应为
,主要副反应为 。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:
。一定温度下,向恒容密闭容器中充入CO2和H2(物质的量之比为1:4)发生反应,容器内气体的压强随时间的变化如表所示:时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 100 | 93.8 | 88.0 | 83.4 | 79.4 | 75.0 | 75.0 |
 的速率,则前120min内CH4的平均反应速率
的速率,则前120min内CH4的平均反应速率
②该温度下,平衡时CO的体积分数为8%,反应
 的平衡常数
的平衡常数
 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
 氯萘是无色挥发性油状液体,不溶于水,易溶于四氯化碳、苯,用于制
氯萘是无色挥发性油状液体,不溶于水,易溶于四氯化碳、苯,用于制 萘酚,用于生产染料、木材防腐剂、杀菌剂、特种清洁剂等。
萘酚,用于生产染料、木材防腐剂、杀菌剂、特种清洁剂等。(1)①
 氯萘与
氯萘与 的混合气体在
的混合气体在 催化作用下涉及到的反应及反应热
催化作用下涉及到的反应及反应热 如下图图1所示,该转化过程中,
如下图图1所示,该转化过程中,
 、
、 、
、 的代数式表示)。
的代数式表示)。
②相同时间内,仅催化剂不同条件下进行反应①


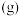 ,生成物的体积分数如下图图2所示,生成物的体积分数不同的原因是
,生成物的体积分数如下图图2所示,生成物的体积分数不同的原因是


①图3中Ⅲ、Ⅳ分别对应反应①、③,则


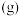 的平衡常数
的平衡常数
②在一定条件下,反应④


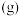 的速率方程
的速率方程 (
( )
) (
( )
) ;
; (
( ),达到平衡时,
),达到平衡时, ,该条件下,某时刻时,
,该条件下,某时刻时, 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、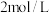 ,则该时刻时,该反应的
,则该时刻时,该反应的
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。若降低温度,
”)。若降低温度, 、
、 均
均 变化的倍数
变化的倍数 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
③在一定的温度和压强下, 和
和 发生反应②
发生反应②


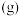 ,下列图像正确且能说明在t时刻该反应达到平衡状态的是
,下列图像正确且能说明在t时刻该反应达到平衡状态的是



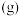 和
和 ,仅发生反应①和反应③,在不同温度下达到平衡时,
,仅发生反应①和反应③,在不同温度下达到平衡时, 氯萘的总转化率和
氯萘的总转化率和 的选择性与温度的关系如下图所示,若
的选择性与温度的关系如下图所示,若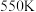 达到平衡时总压为
达到平衡时总压为 ,则该条件下反应③的平衡常数
,则该条件下反应③的平衡常数
 的含量最大。
的含量最大。
反应I:


反应II:


已知:①平衡状态下,甲醛选择性
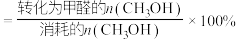 ;甲醛的收率
;甲醛的收率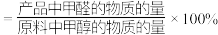 。
。②几种物质的燃烧热
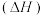 如下表:
如下表:| 物质 |  | 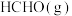 |  |  |
燃烧热 | -725.8 | -563.6 | -283.0 | -285.8 |
(1)

(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii:
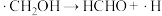
历程iii:

历程iv:
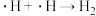
写出历程i的反应方程式:
(3)将
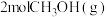 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下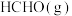 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示: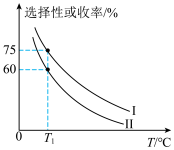
②
 ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为

 。
。
 和
和 充入
充入 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:Ⅰ.
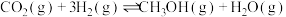
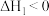 (慢反应)
(慢反应)Ⅱ.

 (快反应)
(快反应)测得相同时间内
 、
、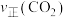 与温度的关系如图所示,下列说法错误的是
与温度的关系如图所示,下列说法错误的是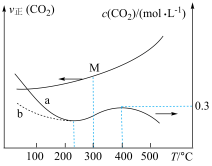
A.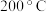 前,加入催化剂可使a线转化为b线 前,加入催化剂可使a线转化为b线 |
B. 时,M点对应的反应体系中, 时,M点对应的反应体系中, |
C.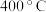 时,若 时,若 时达到平衡,则 时达到平衡,则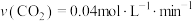 |
D.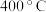 后,温度对正反应速率的影响比浓度大 后,温度对正反应速率的影响比浓度大 |
 下分解:
下分解: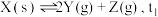 时达到化学平衡,
时达到化学平衡,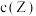 随时间t变化曲线(
随时间t变化曲线( 时间段)如图所示.下列说法错误的是
时间段)如图所示.下列说法错误的是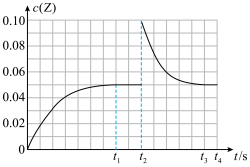
A.在 时间内该化学反应速率 时间内该化学反应速率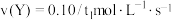 |
| B.T℃时,该反应的化学平衡常数K的值为0.0005 |
| C.Z的体积分数不变证明该分解反应已经达到平衡 |
D.若其他条件不变, 时将容器体积压缩到1L, 时将容器体积压缩到1L, 时达到新的平衡,c(Z)在 时达到新的平衡,c(Z)在 时间内的变化曲线如上图所示 时间内的变化曲线如上图所示 |
 .回答下列问题。
.回答下列问题。(1)汽车在行驶过程中有如下反应发生:

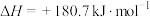

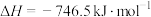
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
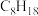 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(3)在汽车上安装三元催化转化器可实现反应:

 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
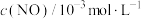 | 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 |
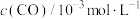 | 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |


 。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)  .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):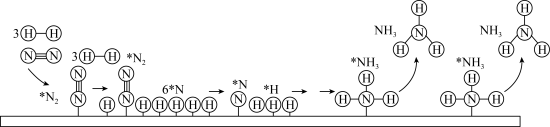
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。(4)研究表明,合成氨的速率与相关物质的浓度关系为
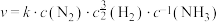 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。| A.合成氨的反应在任意温度下都能自发进行 |
B.增大 、 、 或 或 的浓度都能提高合成氨速率 的浓度都能提高合成氨速率 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)(6)在氨气催化氧化制硝酸过程中,发现
 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①
 (快)
(快) 
②
 (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是
 为催化剂,苯乙烯、
为催化剂,苯乙烯、 为原料制备苯甲醛涉及的主要反应有:
为原料制备苯甲醛涉及的主要反应有:反应i: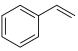 (l)+2H2O2(l)→
(l)+2H2O2(l)→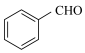 (l)+HCHO(l)+2H2O(l)
(l)+HCHO(l)+2H2O(l)
反应ii: (l)+H2O2(l)→
(l)+H2O2(l)→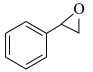 (l)+H2O(l)
(l)+H2O(l)
反应iii: (l)+H2O2(l)→
(l)+H2O2(l)→ (l)+HCHO(l)+H2O(l)
(l)+HCHO(l)+H2O(l)
(1)反应iii的

 。
。(2)根据阿累尼乌斯方程
 (A为指前因子,
(A为指前因子, 为活化能),
为活化能),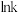 与
与 呈线性关系。据图1可知反应i的活化能
呈线性关系。据图1可知反应i的活化能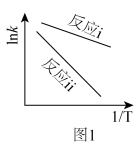
 ,苯乙烯的转化率下降,可能的原因是
,苯乙烯的转化率下降,可能的原因是
(4)
 的催化反应机理如下图所示:
的催化反应机理如下图所示: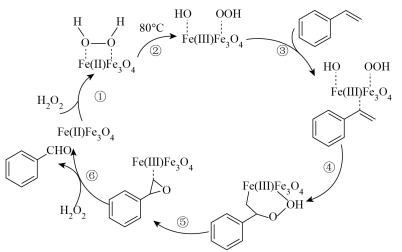
(5)在
 催化下,甲苯可以实现气相氧化制备苯甲醛。
催化下,甲苯可以实现气相氧化制备苯甲醛。(6)主反应: +O2→
+O2→ +H2O
+H2O
副反应:2 +O2→2
+O2→2
(8)
 时,向
时,向 密闭容器中充入
密闭容器中充入 甲苯蒸气和
甲苯蒸气和 ,起始压强为
,起始压强为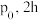 后反应达平衡时容器内气体总物质的量为
后反应达平衡时容器内气体总物质的量为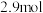 ,甲苯的转化率为
,甲苯的转化率为 。则甲苯的平均反应速率为
。则甲苯的平均反应速率为 ,主反应的
,主反应的
 为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
为平衡分压代替平衡浓度的平衡常数,气体平衡分压=总压×该气体物质的量分数,计算结果保留三位有效数字)。
 ,②
,② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是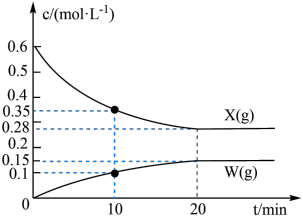
A.10min时,Y(g)的反应速率为0.025 |
| B.体系中W和M的浓度之比保持不变,说明反应已平衡 |
C.平衡时,反应②的平衡常数 |
| D.反应②的活化能比反应①的活化能更大 |
 B+C;②A
B+C;②A B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk—
B+D,反应①的速率可表示为v1=k1c(A),反应②的速率可表示为v2=k2c(A), (k1、k2为速率常数),图1为T2时,该体系中A、B、C、D的浓度随时间变化的曲线,图2为反应①和②的lnk— 曲线,下列说法正确的是
曲线,下列说法正确的是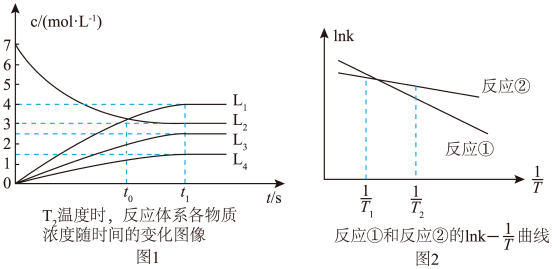
| A.L4表示B浓度随时间变化曲线 |
| B.t1≈2s时曲线L1表示的物质的化学反应速率为2 mol/(L·s) |
| C.T2温度时,反应①的活化能比反应②的活化能大 |
D.若图Ⅰ的温度降低,t0时刻体系中 值变小 值变小 |



