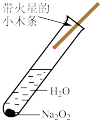名校
1 . 下列装置或操作一定能达到实验目的的是
| 选项 | A | B | C | D |
| 实验 装置 |
|
|
|
|
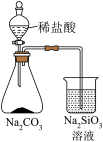
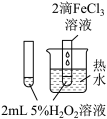
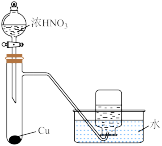
| 实验 目的 | 验证 与水反应生成 与水反应生成 | 验证非金属性强弱: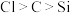 | 验证 对 对 分解反应有催化作用 分解反应有催化作用 | 用Cu和浓硝酸制取并收集 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-14更新
|
324次组卷
|
4卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
2 . 某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(1)写出上述反应的离子方程式___________ 。
(2)能说明温度对该反应速率影响的组合比较是___________ (填实验序号);
(3)C1___________ ;
___________ 。
(4)A和B、A和C的组合比较所研究的问题分别是___________ 、___________ 。
| 实验序号 | 反应温度 | 参加反应的物质 | ||||
 |  |  | ||||
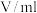 | 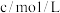 | 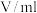 | 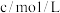 | 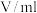 | ||
 |  | 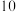 |  | 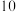 |  |  |
 |  |  |  | 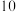 |  |  |
| C |  | 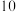 |  |  |  |  |
 |  |  |  | 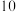 |  |  |
(2)能说明温度对该反应速率影响的组合比较是
(3)C1

(4)A和B、A和C的组合比较所研究的问题分别是
您最近一年使用:0次
名校
3 . 研究反应2X(g) Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度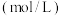 随反应时间
随反应时间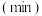 的变化情况如下图所示。下列说法不正确的是
的变化情况如下图所示。下列说法不正确的是
 Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度 随反应时间
随反应时间 的变化情况如下图所示。下列说法不正确的是
的变化情况如下图所示。下列说法不正确的是
| A.比较实验②、④得出:升高温度,化学反应速率加快 |
| B.比较实验①、④得出:升高温度,化学反应速率加快 |
| C.实验③一定是使用了催化剂,催化剂能同等程度改变正、逆反应速率 |
D.在0 10min之间,实验②的平均速率 10min之间,实验②的平均速率 |
您最近一年使用:0次
名校
4 . 在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入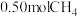 和
和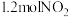 发生反应
发生反应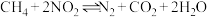 (反应物和产物均为气态)。测得
(反应物和产物均为气态)。测得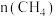 随时间变化的有关实验数据如下表。下列说法不正确的是
随时间变化的有关实验数据如下表。下列说法不正确的是
 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入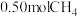 和
和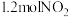 发生反应
发生反应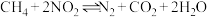 (反应物和产物均为气态)。测得
(反应物和产物均为气态)。测得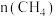 随时间变化的有关实验数据如下表。下列说法不正确的是
随时间变化的有关实验数据如下表。下列说法不正确的是| 组别 | 温度 | 时间/ | 0 | 10 | 20 | 40 | 50 |
| ① |  | 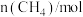 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② |  | 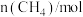 | 0.50 | 0.30 | 0.18 | a | 0.15 |
A.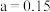 |
B. |
C. 温度下, 温度下,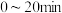 内 内 的反应速率为 的反应速率为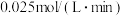 |
D. 温度下,平衡时 温度下,平衡时 的体积分数为 的体积分数为 |
您最近一年使用:0次
2023-07-06更新
|
266次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
5 . 将盐酸滴到碳酸钙固体上,能使反应的最初速率加快的是:
| A.盐酸浓度不变,使用量增大1倍 |
| B.盐酸浓度增加1倍,用量减至1/2 |
| C.将碳酸钙粉末改为块状 |
| D.使反应在较低温度下进行 |
您最近一年使用:0次
名校
6 . 向绝热恒容密闭容器中通入 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
② 浓度:a点大于c点
浓度:a点大于c点
③反应物的总能量高于生成物的总能量
④逆反应速率图像在此时间段内和上图趋势相同
⑤混合物颜色不再变化,说明反应达到平衡
⑥达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为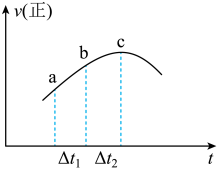
②
 浓度:a点大于c点
浓度:a点大于c点③反应物的总能量高于生成物的总能量
④逆反应速率图像在此时间段内和上图趋势相同
⑤混合物颜色不再变化,说明反应达到平衡
⑥达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
2023-06-01更新
|
491次组卷
|
4卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
7 . 下列实验设计能达到实验目的的是
| 实验目的 | 实验设计 | |
| A | 探究浓度对化学反应速率的影响 | 常温常压下,向一试管中加入10%的 溶液,另一试管中加入 溶液,另一试管中加入 固体和5%的 固体和5%的 溶液,观察现象 溶液,观察现象 |
| B | 制备并得到纯净的溴苯 | 向含溴的苯溶液中加入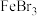 溶液,充分反应后,过滤洗涤 溶液,充分反应后,过滤洗涤 |
| C | 证明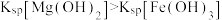 | 向  NaOH溶液中滴加2滴同浓度的 NaOH溶液中滴加2滴同浓度的 溶液后,再滴加2滴同浓度的 溶液后,再滴加2滴同浓度的 溶液,观察现象 溶液,观察现象 |
| D | 验证某溶液中一定含有钾元素 | 用洁净的铁丝蘸取该溶液在酒精灯外焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-16更新
|
137次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗中学2023届高三下学期第六次模拟考试理科综合化学试题
名校
解题方法
8 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究反应物浓度对化学反应速率的影响 | 其他条件不变,取两支试管,一支加入10 mL 0.1 mol/L  溶液,另一支加入5 mL 0.1 mol/L 溶液,另一支加入5 mL 0.1 mol/L  溶液、5 mL蒸馏水,同时向两支试管加入10 mL 0.1mol/L 溶液、5 mL蒸馏水,同时向两支试管加入10 mL 0.1mol/L  溶液 溶液 | 前者出现浑浊的时间更短,说明增大 浓度,可以加快反应速率 浓度,可以加快反应速率 |
| B | 探究压强对化学反应速率的影响 | 其他条件不变,在容积固定的密闭容器中发生反应: 向其中通入氩气,反应速率不变 向其中通入氩气,反应速率不变 | 化学反应速率不受压强影响 |
| C | 证明溶液是否含 | 向溶液中加入稀氢氧化钠溶液,用湿润的红色石蕊试纸靠近瓶口 | 若试纸未变蓝,则说明不含 |
| D | 探究KI与 反应的限度 反应的限度 | 取1 mL 0.1 mol/L KI溶液于试管中,加入5 mL 0.1 mol/L 溶液,充分反应后滴入5滴15% KSCN溶液 溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则KI与 的反应有一定限度 的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-11更新
|
624次组卷
|
3卷引用:宁夏石嘴山市第三中学2022-2023学年高二下学期期末理科化学试题
名校
解题方法
9 . 电解锰渣含有 等。将电解锰渣与电解残液混合制成浆液,能在脱除烟气(含
等。将电解锰渣与电解残液混合制成浆液,能在脱除烟气(含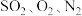 等)中
等)中 的同时,实现电解锰渣的资源化利用。
的同时,实现电解锰渣的资源化利用。
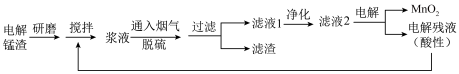
(1)上述流程中为增大反应速率采取的措施有_______ 。
(2)电解锰渣中的 能吸收烟气中的
能吸收烟气中的 ,反应的方程式为
,反应的方程式为_______ 。
(3)电解锰渣与电解残液混合后,浆液中部分离子浓度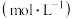 及
及 在脱硫过程中的变化如下。
在脱硫过程中的变化如下。
①用方程式表示脱硫过程溶液 降低的原因
降低的原因_______ 。
②分析浆液中 浓度增大的原因:
浓度增大的原因:
i. 被
被 还原;
还原;
ii. 被
被 还原,离子方程式为
还原,离子方程式为_______ ;
iii._______ (用离子方程式表示)。
(4)电解获得 ,装置如下图所示。
,装置如下图所示。
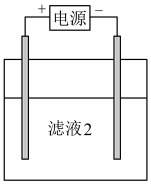
①滤液2在电解池_______ (填“阳”或“阴”)极放电产生 。
。
②净化过程须除去 。研究发现,滤液2中即使含有少量
。研究发现,滤液2中即使含有少量 ,也会导致
,也会导致 产率大幅降低,分析原因:
产率大幅降低,分析原因:_______ 。
 等。将电解锰渣与电解残液混合制成浆液,能在脱除烟气(含
等。将电解锰渣与电解残液混合制成浆液,能在脱除烟气(含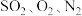 等)中
等)中 的同时,实现电解锰渣的资源化利用。
的同时,实现电解锰渣的资源化利用。
(1)上述流程中为增大反应速率采取的措施有
(2)电解锰渣中的
 能吸收烟气中的
能吸收烟气中的 ,反应的方程式为
,反应的方程式为(3)电解锰渣与电解残液混合后,浆液中部分离子浓度
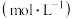 及
及 在脱硫过程中的变化如下。
在脱硫过程中的变化如下。 |  |  |  |  | |
 |  |  | 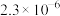 |  | 7.5 |
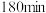 |  | 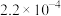 |  | 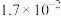 | 1.7 |
 降低的原因
降低的原因②分析浆液中
 浓度增大的原因:
浓度增大的原因:i.
 被
被 还原;
还原;ii.
 被
被 还原,离子方程式为
还原,离子方程式为iii.
(4)电解获得
 ,装置如下图所示。
,装置如下图所示。
①滤液2在电解池
 。
。②净化过程须除去
 。研究发现,滤液2中即使含有少量
。研究发现,滤液2中即使含有少量 ,也会导致
,也会导致 产率大幅降低,分析原因:
产率大幅降低,分析原因:
您最近一年使用:0次
2023-05-07更新
|
555次组卷
|
3卷引用:宁夏回族自治区石嘴山市平罗中学2023届高三下学期第六次模拟考试理科综合化学试题
宁夏回族自治区石嘴山市平罗中学2023届高三下学期第六次模拟考试理科综合化学试题北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
解题方法
10 . 碳达峰、碳中和是现在需要继续完成的环保任务,CO2的综合利用成为热点研究对象,CO2作为碳源加氢是再生能源的有效方法,CO2加氢可以合成甲醇,0lah 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过CO2加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应Ⅰ: CO2 (g)+ H2(g) CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1
反应Ⅱ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
(1)①相关键能如下表,则ΔH1=_______ ,该反应的活化能Ea(正)_______ Ea(逆)(填“大于”“小于”或“等于”)。
②若K1、K2分别表示反应Ⅰ、反应Ⅱ的平衡常数。则CO(g) +2H2(g)  CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=_______ (用含K1、K2的代数式表示)。
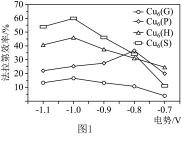
(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是________ 。
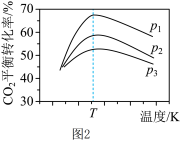
(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:_______ ,解释压强一定时,CO2的平衡转化率呈现如图变化的原因:______ 。
(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=_______ 。
反应Ⅰ: CO2 (g)+ H2(g)
 CO(g) +H2O(g) ΔH1
CO(g) +H2O(g) ΔH1反应Ⅱ: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-41.1KJ·mol-1(1)①相关键能如下表,则ΔH1=
| 化学键 | H-H | C≡ O | O-H | C=O |
| 键能/ (kJ·mol-1) | 436 | 1071 | 464 | 803 |
 CH3OH(g) 的平衡常数K=
CH3OH(g) 的平衡常数K=(2)据文献报道,Cu基纳米材料作为高性能催化剂可将CO2电还原为高能量密度的CH3OH,不同催化剂对生成CH3OH的法拉第效率与电极电势的变化如图1所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是

(3)在催化剂作用下,发生上述反应Ⅰ、Ⅱ, 达平衡时CO2的转化率随温度和压强的变化如图2,判断P1、P2、P3的大小关系:

(4)某温度下,初始压强为10MPa,向容积为2L的恒容密闭容器中充入2 mol CO2、3 mol H2发生反应Ⅰ、Ⅱ,平衡时CO2的转化率是50%,体系内剩余1 mol H2,反应Ⅱ的Kp=
您最近一年使用:0次