名校
解题方法
1 . 小李同学采用如图所示的实验装置测定锌与稀硫酸反应的速率,取1g锌粒与20mL0.5mol·L-1的硫酸进行反应,测得不同时刻反应生成的H2的体积(已折算为标准状况)如表。下列说法正确的是


| t/s | 0 | 5 | 10 | 15 | 20 | 25 |
| V(H2)/mL | 0.0 | 14.6 | 34.5 | 44.8 | 52.2 | 56.9 |
| A.反应结束时锌粒无剩余 |
| B.锌与稀硫酸反应初期速率逐渐加快,后又变慢 |
| C.应用锌粉代替锌粒进行实验,以节约实验时间 |
| D.假设溶液的体积不变,10~25s内的平均反应速率v(H2SO4)=0.02mol·L-1·min-1 |
您最近一年使用:0次
2022-02-15更新
|
395次组卷
|
6卷引用:宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题
宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题河南省部分名校大联考2021-2022学年高二上学期期末考试化学试题河南省豫北名校2021-2022学年高二下学期4月份教学质量检测化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)【精品卷】2.1.1 化学反应速率课堂例题-人教版2023-2024学年选择性必修1(已下线)寒假作业02 化学反应速率-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
解题方法
2 . 下列实验操作、现象和所得到的结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热,铝箔熔化并滴落 | 金属铝的熔点较低 |
| B | 相同条件下,在两支试管中各取4mL0.1mol∙L−1KMnO4,分别加入2mL0.1mol∙L−1H2C2O4和2mL0.01mol∙L−1H2C2O4,加入2mL0.1mol∙L−1H2C2O4溶液褪色较快 | 浓度越大,化学反应速率越快 |
| C | 向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀 | 原溶液中有Fe2+,无Fe3+ |
| D | 将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的“黑面包”并产生有刺激性气味的气体 | 该过程体现了浓硫酸的脱水性和强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-01更新
|
275次组卷
|
2卷引用:宁夏平罗中学2022-2023学年高二下学期期末考试(重点班)化学试题
名校
解题方法
3 . 少量铁粉与100 mL 0.1 mol/L的稀盐酸反应,若想减慢此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
①加H2O ②降温 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦加KNO3溶液
| A.①④⑤⑦ | B.②③⑥ | C.①②⑤⑦ | D.①②④⑤ |
您最近一年使用:0次
2021-11-12更新
|
482次组卷
|
6卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题
宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题天津市五校联考2021-2022学年高二上学期期中考试化学试题新疆喀什第二中学2021-2022学年高三下学期开学考试化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题安徽省安庆市第七中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 对于反应C(s)+H2O(g) CO(g)+H2(g),现采取下列措施,其中能够使反应速率加快的措施是
CO(g)+H2(g),现采取下列措施,其中能够使反应速率加快的措施是
 CO(g)+H2(g),现采取下列措施,其中能够使反应速率加快的措施是
CO(g)+H2(g),现采取下列措施,其中能够使反应速率加快的措施是| A.恒容下充入氦气 | B.增加碳的质量 |
| C.缩小容器体积,增大压强 | D.及时移出生成的CO |
您最近一年使用:0次
2021-10-29更新
|
262次组卷
|
4卷引用:宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
5 . 一定质量的锌和足量的0.5mol/L的盐酸反应,为加快反应速率,又不影响生成氢气的总量可采用的方法是
| A.加入适量浓度为0.5mol/L的硫酸 | B.加入几滴 溶液 溶液 |
C.加入几滴 溶液 溶液 | D.加入少量 溶液 溶液 |
您最近一年使用:0次
2021-10-19更新
|
258次组卷
|
5卷引用:宁夏石嘴山市第三中学2023-2024学年高二上学期第二次月考化学试题
6 . H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是
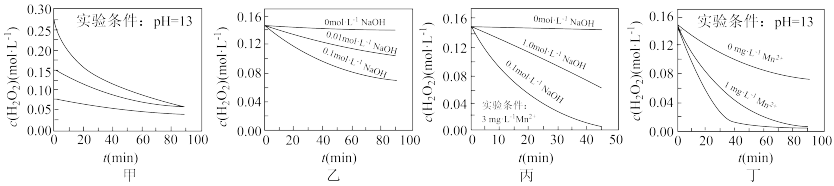

| A.图甲表明,其他条件相同时,H2O2浓度越大,其分解速率越快 |
| B.图乙表明,其他条件相同时,NaOH溶液浓度越小,H2O2分解速率越慢 |
| C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 |
| D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
您最近一年使用:0次
2021-05-10更新
|
2752次组卷
|
44卷引用:宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题
宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试化学(江苏卷精编版)山东省临沂市2016-2017学年高一下学期期末考试化学试题山西省吕梁市2018届高三上学期第一次阶段性测试化学试题福建省泉州市泉港区第一中学2017-2018学年高二年上学期期末考化学试题重庆市第八中学2017-2018学年高一下学期期中考试化学试题【全国百强校】广西桂林市第十八中学2017-2018学年高一下学期期中考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题【市级联考】安徽省池州市2019-2020学年高二第一学期九月份素质检测(开学考试)化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题安徽省滁州市定远县民族中学2020届高三上学期期中考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题河北省唐山市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》福建省莆田九中2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月20日 《每日一题》人教版(选修4)——外界条件对化学反应速率的影响步步为赢 高二化学寒假作业:综合检测(二)上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——影响化学反应速率的因素(提升练)2020届高三化学二轮复习 化学反应速率 化学平衡(专题训练)2020届高三化学知识点强化训练—化学影像速率的图象分析第二章 化学反应与能量学 模拟高考——C 挑战区 夯实基础(人教版必修2)第六章 化学反应与能量 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分江西省赣州市蓉江新区潭口中学2019-2020学年高二下学期第一次月考化学试题河南省开封市2019-2020学年高一下学期期末调研考试化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题(已下线)2.2+影响化学反应速率的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)必修第二册RJ第6章模拟高考(已下线)【浙江新东方】54.(已下线)小题必刷27 化学反应速率、图像及其影响因素——2021年高考化学一轮复习小题必刷(通用版本)浙江省淳安县汾口中学2020-2021学年高二12月月考化学试题安徽省合肥市第一中学2020-2021学年高一下学期期中考试化学试题黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题山东省淄博市2020-2021学年高二下学期期末考试化学试题湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题黑龙江省齐齐哈尔市第八中学2021-2022学年高一下学期期中考试化学试题
解题方法
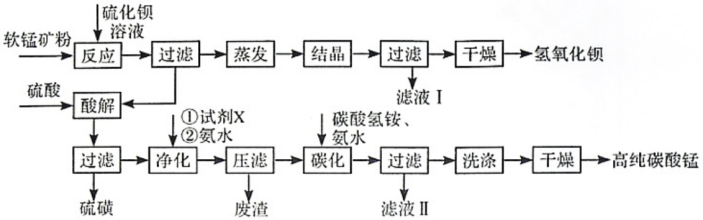
7 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
名校
解题方法
8 . 对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是
 2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是| A.增大压强 | B.升高温度 | C.使用催化剂 | D.多充入O2 |
您最近一年使用:0次
2021-03-04更新
|
715次组卷
|
26卷引用:宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题
宁夏石嘴山市平罗中学2021-2022学年高二下学期第一次月考化学试题新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(1-3班)试题四川省广安市武胜烈面中学校2020-2021学年高二下学期开学考试化学试题吉林省长春外国语学校2020-2021学年高一下学期期末考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题浙江省诸暨市2017-2018学年高一下学期期末考试化学试题 吉林省大安市第六中学2021-2022学年高二上学期期中考试化学试题河北省唐山市第十一中学2021-2022学年高二上学期期中考试化学试题甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题云南省丽江市第一高级中学2021-2022学年高二上学期期中考试化学试题陕西省西安市西航一中2021-2022学年高二上学期第二次月考化学试题甘肃省玉门市2021-2022学年高二下学期 “研课标读教材”期中学业质量监测试化学试题(一)内蒙古包头市第四中学2020-2021学年高二上学期第一次月考化学试题云南省富源县第一中学2020-2021学年高二上学期第一次统测化学试题吉林江城中学2021-2022学年高二上学期期中考试化学试题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题黑龙江省佳木斯市第十二中学2022-2023学年高二上学期期中考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题北京昌平区新学道临川学校2021-2022学年高二上学期期中考试化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题贵州省龙里中学2022-2023学年高二上学期11月期中考试化学试题辽宁省大连市第四十八中学2023-2024学年高二上学期10月月考化学试题福建省福州屏东中学2023-2024学年高二上学期期中考试化学试题陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷青海省西宁市海湖中学2023-2024学年高二上学期第二次阶段考试化学试题
10-11高一下·江西上饶·期中
名校
解题方法
9 . 影响化学反应速率的主要因素是
| A.浓度 | B.催化剂 | C.反应物本身的性质 | D.温度 |
您最近一年使用:0次
2021-01-14更新
|
615次组卷
|
50卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题
宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题(已下线)2010-2011学年江西省鄱阳县油墩街中学高一下学期期中考试化学试卷(已下线)2010-2011学年河南省许昌市高一下学期四校期中联考化学试卷(已下线)2011-2012学年四川省金堂中学高一下学期期中考试化学试卷(已下线)2011-2012学年四川成都外国语学校高一下学期期中考试化学试卷(已下线)2011-2012学年广东省连州中学高一下学期期中考试化学试卷(已下线)2012—2013学年中大附中三水实验学校高二上期中文科化学试卷(已下线)2012-2013学年福建省福州文博中学高一下学期期末考试化学试卷(已下线)2012-2013学年四川省资阳市高一下学期期末检测化学试卷(已下线)2013-2014四川省资阳市高一下学期期末考试化学试卷(已下线)2014-2015学年山西大学附中第一学期高二化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年河北省望都中学高二上学期第二次月考化学试卷2015-2016学年四川省香港马会第五中学高二上10月月考化学试卷2015-2016学年吉林省吉林五十五中学高二上学期期末考试化学试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年浙江金华、温州、台州三市部分学校高一下期中化学卷2016-2017学年湖北省宜昌市葛洲坝中学高二上期中化学卷浙江省台州市书生中学2017-2018学年高二上学期第一次月考化学试题黑龙江省大庆市东风中学2017-2018学年高二上学期期中考试化学试题广东省深圳市罗湖区2017-2018学年高二上学期期末模拟化学试题河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题黑龙江省大庆十中2017-2018学年高一下学期期末考试化学试题浙江省宁波市咸祥中学2018-2019学年高二上学期期中考试化学试题湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷河北省唐山市开滦第二中学2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)重庆市云阳县2019-2020学年高二上学期期中考试化学试题宁夏银川市长庆高级中学2019-2020学年高一下学期期中考试化学试题新疆吐蕃市高昌区第二中学2019-2020学年高一下学期期末考试化学试题福建省福州福清市2017-2018学年高二上学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题河北省石家庄市康福外国语学校2020-2021学年高二10月月考化学试题陕西省子洲中学2018-2019学年高一下学期期中考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题江苏省淮安市高中校协作体2020-2021学年高一下学期期中考试化学试题新疆喀什巴楚县第一中学2020-2021学年高二下学期期中考试化学试题宁夏长庆高级中学2020-2021学年高一上学期期中考试化学试题2四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷辽宁省清原满族自治县第二高级中学2020-2021学年高二上学期期中考试化学试题广东省肇庆市实验中学2021-2022学年高二上学期期中考试化学试题广东省珠海市2023-2024年高二上学期期中联考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题
10-11高二上·广东梅州·阶段练习
名校
解题方法
10 . 下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子百分数,使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子个数,从而使反应速率增大 |
| C.升高温度,能增加反应物分子中活化分子百分数,使化学反应速率增大 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
您最近一年使用:0次
2021-01-08更新
|
530次组卷
|
53卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题
宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题(已下线)2010年广东省梅州市曾宪梓中学高二10月考化学(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省苏州五中高二第二学期期中考试化学试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2015届福建省八县一中高二上学期半期联考化学试卷2015-2016学年内蒙古包头九中高一6月月考化学试卷江西省南昌市八一中学、洪都中学、麻丘高中等六校2017-2018学年高二10月联考化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题安徽省定远重点中学2017-2018学年高二上学期期末考试化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高二上学期9月月考化学试题甘肃省武威市第十八中2018-2019学年高二上学期第一次月考化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题吉林省长春市吉林省实验中学2019-2020学年高二上学期期中考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高二上学期第一次阶段考试化学试题吉林省吉林市顶级名校2019-2020学年高二上学期12月月考化学考试题浙江省浙东北联盟(ZDB)2019-2020学年高二上学期期中考试化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——影响化学反应速率的因素(强化练习)新疆阿克苏市实验中学2019-2020学年高二上学期第一次月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2020届高三上学期第二次月考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 方法帮陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题四川省仁寿第一中学校南校区2020-2021学年高二10月月考理综化学试题浙江省宁波诺丁汉大学附属中学2020-2021学年高二上学期10月月考化学试题(已下线)【浙江新东方】43人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时3 活化能福建省泉州市泉港区第一中学2020-2021学年高二上学期期中考试化学试题内蒙古巴彦淖尔市临河三中2020-2021学年高二10月考化学试题辽宁省辽河油田第二高级中学2020-2021学年高二上学期期中考试化学试题湖南省雅礼中学2020-2021学年高二上学期第三次月考化学试题福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题天津市新华中学2020-2021学年高二上学期第一次月考化学试题山东省曲阜市第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古北京四中呼和浩特分校2021-2022学年高二上学期第一次月考化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题



