解题方法
1 . 下列有关实验或操作能达到实验目的的是


| A.①证明Ksp(AgCl)>Ksp(AgI) |
| B.②装置蒸发氯化铝溶液制备无水氯化铝 |
| C.③装置用已知浓度的盐酸滴定未知浓度的NaOH溶液 |
| D.④验证二氯化锰对过氧化氢的分解能起到催化的作用 |
您最近半年使用:0次
2022-10-28更新
|
747次组卷
|
2卷引用:新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题
名校
2 . 下列设计的实验方案能达到实验目的的是
| A.制备Al(OH)3悬浊液:向1mol·L-1的AlCl3溶液中加过量的6mol·L-1NaOH溶液 |
| B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 |
| C.检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 |
| D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
您最近半年使用:0次
2016-12-09更新
|
198次组卷
|
6卷引用:新疆乌鲁木齐市第八中学2020届高三第一次月考化学试题
名校
解题方法
3 . 下列实验设计及操作能达到实验目的的是
| A | B | C | D |
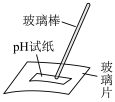 | 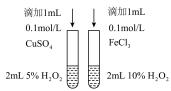 | 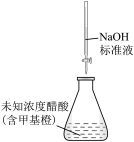 | 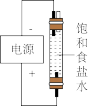 |
| 测NaClO溶液的pH | 比较 、 、 对反应速率的影响 对反应速率的影响 | 测定醋酸浓度 | 制备“84”消毒液 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-10-03更新
|
0次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高三上学期11月月考化学试题
名校
4 . 下列图示装置不能达到实验目的的是


| A.图1:验证温度对化学平衡的影响 |
| B.图2:测定锌与稀硫酸的反应速率 |
| C.图3:验证FeCl3溶液对H2O2分解有催化作用 |
| D.图4:研究浓度对反应速率的影响 |
您最近半年使用:0次
2021-11-18更新
|
243次组卷
|
7卷引用:新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
5 . 下列实验操作能达到实验目的的是
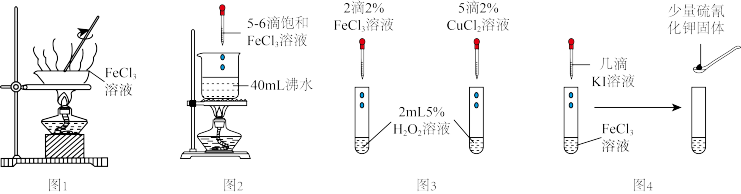

| A.图1:加热蒸干FeCl3溶液制备FeCl3固体 |
| B.图2:制备Fe(OH)3胶体 |
| C.图3:比较Fe3+、Cu2+对H2O2分解的催化效果 |
| D.图4:验证FeCl3与KI的反应是可逆反应 |
您最近半年使用:0次
2022-12-07更新
|
239次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题
6 . 利用下列装置(夹持装置略)进行实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 实验 | 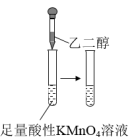 |  | 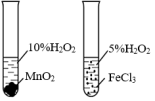 | 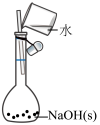 |
| 实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 除去SO2的少量HCl | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 配制0.10mol/L的NaOH溶液 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-09-05更新
|
56次组卷
|
2卷引用:新疆克孜勒苏柯尔克孜自治州阿合奇县2022-2023学年高二上学期11月期中考试化学试题
名校
7 . 根据下列实验所得结论正确的是
| 选项 | A | B | C | D |
| 装置 | 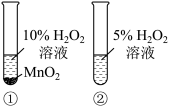 | 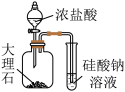 | 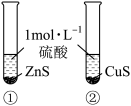 |  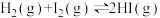 达到平衡状态 |
| 现象 | ①中产生大量气泡 ②中无明显现象 | 试管中溶液出现浑浊 | ①中固体溶解 ②中固体不溶解 | 压缩体积,气体颜色加深 |
| 结论 |  是 是 分解的催化剂 分解的催化剂 | 酸性:碳酸>硅酸 | ZnS的溶解度大于CuS | 增大压强,上述平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-11-15更新
|
189次组卷
|
2卷引用:新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为_________________________________________ 。
(2)甲同学的实验目的是_____________ ;要得出正确的实验结论,还需控制的实验条件是____________ 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
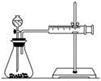
(3)乙同学在实验中应该测定的数据是___________________________________________________ 。
(4)乙同学完成该实验应选用的实验药品是________ ,该实验中不选用某浓度的硫酸,理由是___________ 。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________ 的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是

(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
您最近半年使用:0次
2016-12-09更新
|
1625次组卷
|
8卷引用:新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题
新疆阿勒泰地区2019-2020学年高一下学期期末考试化学(B)试题(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题
10-11高一下·辽宁·期中
名校
9 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
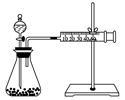
(1)该同学的实验目的是________________________ ;要得出正确的实验结论,还需控制的实验条件是________________________________________ 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________ ;应该测定的实验数据是________________________________________________________________________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________ 的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________ 。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |

(1)该同学的实验目的是
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
您最近半年使用:0次
2016-12-09更新
|
1010次组卷
|
6卷引用:2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷
(已下线)2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷(已下线)2013届新疆乌鲁木齐市一中高一下学期平行班期中考试化学试卷(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
10 . 制备乙酸乙酯是中学有机化学中的一个重要实验。某化学学习小组的同学查阅资料发现,某些无机盐类也可以催化乙酸乙酯的合成,为了探究不同盐的催化效果,设计了如下实验:
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3mL无水乙醇和2mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。
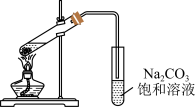
(1)实验时,需要加入几粒沸石,目的是_______ 。
(2)催化剂用量为3mmol(以阳离子计),选用的催化剂A可能是_______ (填标号)。
a.氯化铜晶体b.硫酸钙晶体c.碳酸钠晶体d.硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用_______ 。
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为_______ ,反应类型_______ 。
(4)实验中用饱和碳酸钠溶液的作用是_______ 。得到的混合液经_______ ,蒸馏,最终得到较纯净的乙酸乙酯。
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3mL无水乙醇和2mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。

| 催化剂 | 酯层高度/cm | 催化剂 | 酯层高度/cm |
| 氯化铁晶体 | 2.7 | 氯化铝 | 3.2 |
| A | 2.2 | 氯化钠 | 0.0 |
(2)催化剂用量为3mmol(以阳离子计),选用的催化剂A可能是
a.氯化铜晶体b.硫酸钙晶体c.碳酸钠晶体d.硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为
(4)实验中用饱和碳酸钠溶液的作用是
您最近半年使用:0次
2022-05-05更新
|
110次组卷
|
2卷引用:新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题



