名校
解题方法
1 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为___________ 。
(2)为探究 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入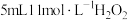 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为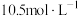 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为___________ 。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。
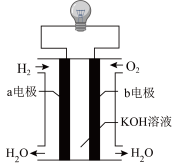
①该电池的正极是电极___________ (填“a”或“b”),负极发生反应的方程式为___________ 。
②电池工作时,当外电路中转移 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为___________ 。
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为
(2)为探究
 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入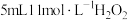 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为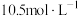 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
| 试管编号 | 实验目的 |  溶液 溶液 | 温度 | 水的体积/mL |  溶液体积/mL 溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号Ⅱ实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 12% | 5.0 | 60℃ | 0 | 0 |
| Ⅲ | 为编号Ⅳ实验的参照 | 4.0% | 5.0 | 常温 | ① | 0 |
| Ⅳ | ② | 4.0% | 5.0 | 常温 | 0 | 1.0 |

①该电池的正极是电极
②电池工作时,当外电路中转移
 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为
您最近半年使用:0次
2023-05-16更新
|
229次组卷
|
2卷引用:广东省广州市第六十五中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
2 . 下图有关实验或操作能达到实验目的的是


A.①证明 |
| B.②装置蒸发氯化铝溶液制备无水氯化铝 |
C.③装置可判断 反应的热效应 反应的热效应 |
| D.④验证氯化铁对过氧化氢的分解有催化作用 |
您最近半年使用:0次
名校
3 . 利用下列装置(部分夹持装置略)进行相应实验(或操作)能边到实验目的的是
| A | B | C | D |
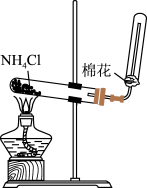 | 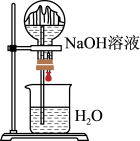 |  | 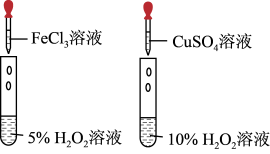 |
| 实验室制备氨气 | 将NO与O2按照4:1混合充满烧瓶进行喷泉实验,最后水能充满烧瓶 | 收集NO气体 | 比较CuSO4、FeCl3对H2O2分解的催化效果 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-05-11更新
|
234次组卷
|
3卷引用:广东省广州中学2020-2021学年高一下学期期中考试化学试题
名校
4 . 用下列装置进行的实验, 能达到相应实验目的的是
A. 配制一定浓度的硫酸溶液 配制一定浓度的硫酸溶液 | B.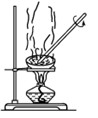 分离溶解在CCl4中的I2 分离溶解在CCl4中的I2 |
C. 制备和收集少量NH3 制备和收集少量NH3 | D.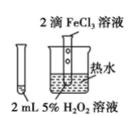 验证FeCl3 对 H2O2分解有催化作用 验证FeCl3 对 H2O2分解有催化作用 |
您最近半年使用:0次
2017-03-31更新
|
892次组卷
|
5卷引用:广东省佛山市第一中学2021-2022学年高三上学期12月模拟考试化学试题
广东省佛山市第一中学2021-2022学年高三上学期12月模拟考试化学试题2017届四川省宜宾市高三第二次诊断理科综合能力测试化学试卷江西省宜丰中学2019届高三上学期第三次月考理科综合化学试题江苏省沭阳县修远中学2018-2019学年高一下学期第二次月考(实验班)化学试题(已下线)江苏省沭阳县修远中学2018-2019学年高一下学期第二次月考化学试题
名校
5 . 某学习小组对硝酸工业活性炭脱硝工艺进行探究。回答下列问题:
Ⅰ.硝酸工业产生的烟气中含有大量 ,工艺如图所示:
,工艺如图所示:
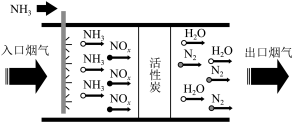
(1)该流程中活性炭是催化剂,加入催化剂的目的是___________ 。
(2)若要使 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为___________ (用含x的式子表示)。
Ⅱ.某同学为了探究干燥条件下 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。

(3)装置A为氨气的发生装置,应选用___________ (填“X”或“Y”)为此实验制备氨气的装置,相关反应的化学方程式为___________ 。
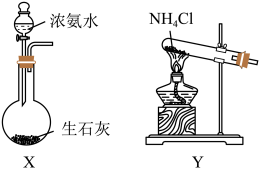
(4)该实验设计中存在缺陷,请写出解决方案:___________ 。
(5)装置D用于制备 气体。
气体。
①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为___________ 。
②装置D中发生反应的实验现象为___________ 。
③ 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作___________ 。
Ⅰ.硝酸工业产生的烟气中含有大量
 ,工艺如图所示:
,工艺如图所示:
(1)该流程中活性炭是催化剂,加入催化剂的目的是
(2)若要使
 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为Ⅱ.某同学为了探究干燥条件下
 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。
(3)装置A为氨气的发生装置,应选用

(4)该实验设计中存在缺陷,请写出解决方案:
(5)装置D用于制备
 气体。
气体。①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为
②装置D中发生反应的实验现象为
③
 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作
您最近半年使用:0次
名校
解题方法
6 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为________ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
I.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
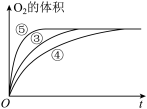
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?________ 。
III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:________ 。
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol/LFeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LFeCl3溶液 |
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?

III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
您最近半年使用:0次
名校
7 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是___________ 。

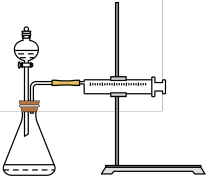
(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
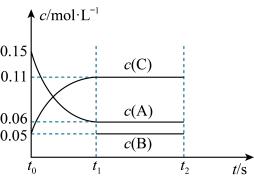
①写出反应的化学方程式:___________ ;
②B的起始的物质的量是___________ ;平衡时体系内的压强为初始状态的___________ 倍。
| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25mL3%H2O2溶液 | 无 |
| ② | 20 | 25mL5%H2O2溶液 | 无 |
| ③ | 20 | 25mL5%H2O2溶液 | 0.1gMnO2 |
| ④ | 20 | 25mL5%H2O2溶液 | 1~2滴1mol/LFeCl3溶液 |
| ⑤ | 30 | 25mL5%H2O2溶液 | 0.1gMnO2 |
(1)实验①和②的目的是
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是

(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①写出反应的化学方程式:
②B的起始的物质的量是
您最近半年使用:0次
2023-10-04更新
|
19次组卷
|
2卷引用:广东省 广州市西关培英中学2023-2024学年高二上学期11月期中化学试题
解题方法
8 . 下列实验能达到预期目的是
| 选项 | 实验内容 | 实验目的 |
| A | 将 的KI溶液和 的KI溶液和 的 的 溶液等体积混合,充分反应后,取少许混合液滴加 溶液等体积混合,充分反应后,取少许混合液滴加 溶液 溶液 | 验证 与 与 的反应有一定限度 的反应有一定限度 |
| B | 分别测浓度均为 的 的 和 和 溶液的pH 溶液的pH | 比较 和 和 的水解常数 的水解常数 |
| C | 相同条件下,向一支试管中加入2mL5% 和1mL 和1mL ,向另一支试管中加入2mL5% ,向另一支试管中加入2mL5% 和1mL 和1mL 溶液,观察并比较实验现象 溶液,观察并比较实验现象 | 探究 对 对 分解速率的影响 分解速率的影响 |
| D | 向2支盛有5mL不同浓度 溶液的试管中,同时加入2mL5% 溶液的试管中,同时加入2mL5% 溶液,观察并比较实验现象 溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
22-23高三上·吉林长春·期末
名校
解题方法
9 . 下列实验操作可以达到实验目的的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将1mL  溶液与1mL 溶液与1mL KI溶液混合,充分反应后分为两份,一份加2滴KSCN,另一份加2滴淀粉试液,观察现象 KI溶液混合,充分反应后分为两份,一份加2滴KSCN,另一份加2滴淀粉试液,观察现象 | 证明KI与 能反应且具有可逆性 能反应且具有可逆性 |
| B | 向两支盛有2mL5% 溶液的试管中分别加入 溶液的试管中分别加入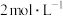 的 的 溶液和 溶液和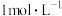 的 的 溶液,比较产生气泡速率 溶液,比较产生气泡速率 |  催化 催化 分解效果优于 分解效果优于 |
| C | 向饱和 溶液中通入某无色无味气体X,观察是否有沉淀生成 溶液中通入某无色无味气体X,观察是否有沉淀生成 | 确定X是否为 |
| D | 用pH计分别测定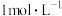 和 和 的 的 溶液的pH,记录并比较pH变化 溶液的pH,记录并比较pH变化 | 随着溶液中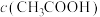 减小, 减小, 的电离程度增大 的电离程度增大 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . 根据下列实验设计,回答问题:
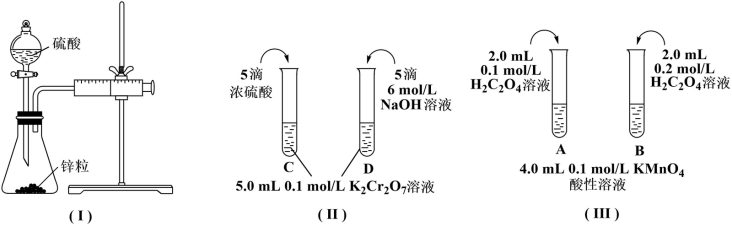
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为___ ,用平衡移动原理解释原因:___ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___ ,推测该实验设计___ (填“能”或“不能”)达到实验目的,判断理由是___ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
①由实验ⅰ、实验ⅱ可得出的结论是___ 。
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___ ,最后加入5mL0.1mol/L草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近半年使用:0次



