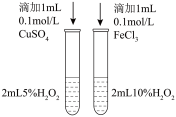
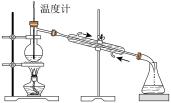
1 . 如图实验装置和方法进行相应实验,装置和现象均正确且能达到实验目的的是
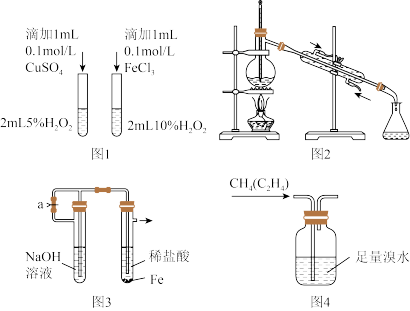

| A.图1比较Cu2+、Fe3+对反应速率的影响 |
| B.图2蒸馏海水得到淡水 |
| C.图3制备少量Fe(OH)2沉淀 |
| D.图4除甲烷中的乙烯 |
您最近半年使用:0次
名校
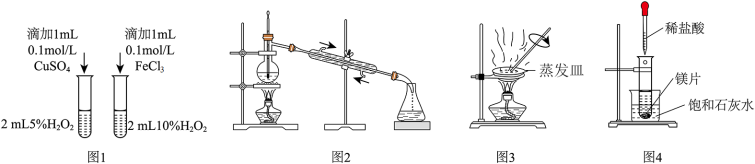
2 . 如图实验装置和方法进行相应实验,装置和现象均正确且能 达到实验目的的是
| A | B | C | D |
 |  | 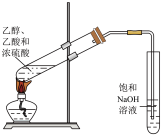 |  |
比较 、 、 对反应速率的影响 对反应速率的影响 | 蒸馏海水得到淡水 | 制取少量乙酸乙酯 | 验证镁片与稀盐酸反应放热 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
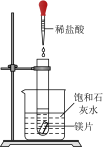
3 . 如图实验装置和方法进行相应实验,装置和现象均正确且能达到实验目的的是

| A.图1是比较Cu2+、Fe3+对反应速率的影响 |
| B.图2是蒸馏海水得到淡水 |
| C.图3是蒸干NaHCO3溶液获得NaHCO3晶体 |
| D.图4是验证镁片与稀盐酸反应放热 |
您最近半年使用:0次
名校
4 . 为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是___ 。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是____ (用实验中所提供的几种试剂)。
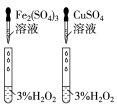
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:
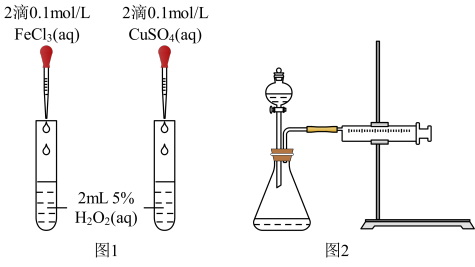
①定性分析:如图1可通过观察____ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是___ 。
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是___ 。
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
①实验结果表明,催化剂的催化效果与___ 有关。
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因___ 。
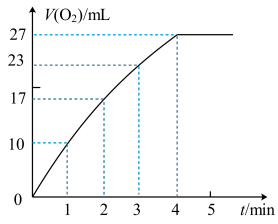
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡;试管B中产生的气泡量增多 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液 | 两支试管中均未明显见到有气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图所示的实验。请回答相关问题:

①定性分析:如图1可通过观察
②定量分析:用图2所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(4)MnO2对H2O2分解反应也有催化作用,另一个同学用图2装置,将状态不同的1gMnO2分别加入盛有30mL等浓度的H2O2溶液的锥形瓶中,产生气体进入注射器针筒中,记录结果如下:
| MnO2状态 | 触摸锥形瓶情况 | 该温度下针筒内收集到气体的体积 | 所需时间 |
| 粉末状 | 很烫 | 30mL | 3min |
| 块状 | 微热 | 30mL | 9min |
②实验过程中放出气体的体积(标准状况)和时间的关系如图所示。解释反应速率变化的原因
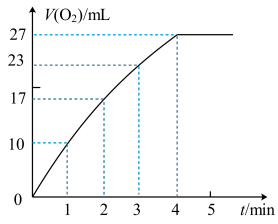
您最近半年使用:0次
5 . 用下列仪器或装置(图中夹持略)进行相应实验,能达到实验目的的是
| A | B | C | D |
 |  |  |  |
蒸发结晶制备 晶体 晶体 | 检验溴乙烷消去产物 | 分离苯和溴苯 | 探究不同催化剂 对  分解速率的影响 分解速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-03-18更新
|
655次组卷
|
6卷引用:福建省漳州市七校(厦大附中、龙海一中、南靖一中、平和一中、诏安一中、长泰一中、龙海二中)2021-2022学年高三下学期毕业班4月诊断性联考化学试题
名校
6 . 利用如图实验装置进行相应实验,能达到实验目的的是
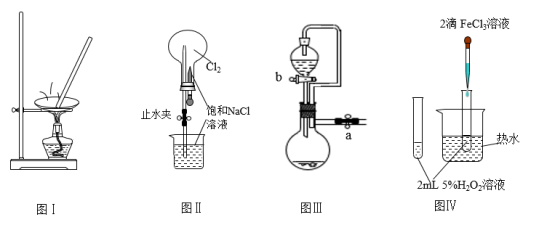

| A.利用图Ⅰ装置蒸发KCl溶液制备无水KCl |
| B.利用图Ⅱ装置进行喷泉实验 |
| C.图Ⅲ装置中,关闭a、打开b,可检查装置的气密性 |
D.利用图Ⅳ装置验证 分解反应有催化作用 分解反应有催化作用 |
您最近半年使用:0次
2021-10-11更新
|
361次组卷
|
5卷引用:福建省莆田市第二中学2022届高三10月月考化学试题
福建省莆田市第二中学2022届高三10月月考化学试题福建省泉州市城东中学2021-2022学年高三上学期10月月考化学试题福建省福州市六校联考2022-2023学年高一下学期期末考试化学试题(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
名校
7 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业,是一种浅黄色、遇水易分解的固体,但溶于浓硫酸后并不分解。某实验小组将在A中产生的SO2通入浓硫酸和浓硝酸的混合溶液中制备亚硝酰硫酸,并测定产品的纯度。
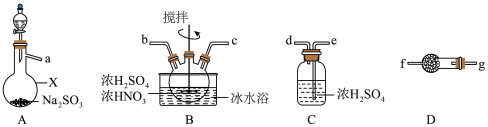
(1)仪器X的名称为___________ ;
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)___________ 。
(3)①装置B中发生反应的化学方程式为___________ 。
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是___________ 。
(4)装置B中维持反应体系温度不高于20℃的主要原因是___________ 。
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为___________ 。
②该产品的纯度为___________ % (保留小数点后一位)。

(1)仪器X的名称为
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)
(3)①装置B中发生反应的化学方程式为
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是
(4)装置B中维持反应体系温度不高于20℃的主要原因是
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为
②该产品的纯度为
您最近半年使用:0次
名校
8 . 过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氯化钙。
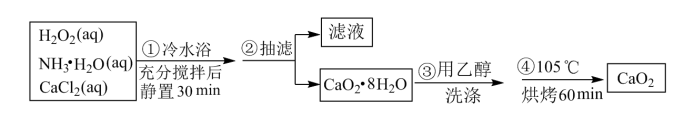

(1)三颈烧瓶中发生的主要反应的化学方程式为_______ 。
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是_______ 。
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,_______ ;
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为_______ 。
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是_______ 。
②滴定终点的现象为_______ 。
③产品的纯度为_______ (用字母表示)。
④若第三步用稀盐酸溶解,所测纯度_______ (填“偏低”“不变”或“偏高”)


(1)三颈烧瓶中发生的主要反应的化学方程式为
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是
②滴定终点的现象为
③产品的纯度为
④若第三步用稀盐酸溶解,所测纯度
您最近半年使用:0次
9 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
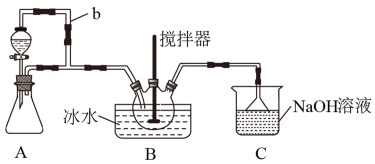
(1)装置A制取SO2
①A中反应的化学方程式为___ 。
②导管b的作用是___ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___ (只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___ 。
(3)装置C的主要作用是___ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__ MnO4-+__ C2O42-+__ =__ Mn2++__ +__ H2O
②滴定终点时的现象为___ 。
③亚硝酰硫酸的纯度=___ 。(精确到0.1%)[M(NOSO4H)=127g·mol-1]

(1)装置A制取SO2
①A中反应的化学方程式为
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:
②滴定终点时的现象为
③亚硝酰硫酸的纯度=
您最近半年使用:0次
2020-03-10更新
|
390次组卷
|
3卷引用:【市级联考】福建省泉州市2019届高三毕业班下学期第一次质量检查理科综合化学试题
10 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速度 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色变化 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol/L和40mL18mol/L的硫酸,比较两者收集10mL氢气所用的时间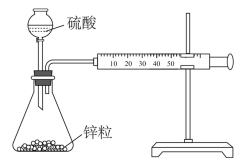 | 探究硫酸浓度对反应速率的影响 |
| D | 在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-11-12更新
|
161次组卷
|
2卷引用:福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题



