名校
解题方法
1 . 科研人员提出催化合成碳酸二甲酯(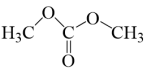 )的示意图如图所示,下列说法错误的是
)的示意图如图所示,下列说法错误的是

 )的示意图如图所示,下列说法错误的是
)的示意图如图所示,下列说法错误的是
A.过程①中有 键的断裂 键的断裂 |
B. 是中间产物 是中间产物 |
C.总反应的化学方程式为CO2+2CH3OH  +H2O +H2O |
| D.二氧化碳、甲醇、碳酸二甲酯均能与NaOH溶液反应 |
您最近一年使用:0次
2022-07-21更新
|
92次组卷
|
6卷引用:福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题
福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题河南省濮阳市2021-2022学年高三上学期期中考试(11月考)化学试题江西省石城中学2022-2023学年高二下学期第三次半月考化学试题河南省名校大联考2021-2022学年高三上学期期中考试化学试题 江西省抚州市部分中学2021-2022学年高二下学期联考化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)
名校
解题方法
2 . 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
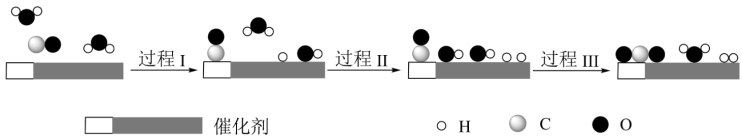
下列说法正确的是
 CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.使用催化剂降低了水煤气变换反应的ΔH |
| C.该催化过程中:有极性键的断裂,极性键和非极性键的形成 |
| D.图示显示:起始时的2个H2O在反应过程中并未都参与了反应 |
您最近一年使用:0次
名校
3 . 过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下操作与装置(部分固定装置略)制备过氯化钙。
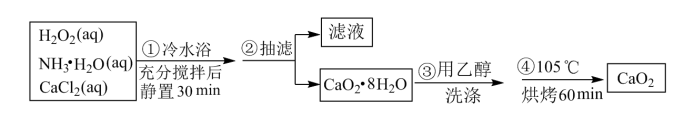

(1)三颈烧瓶中发生的主要反应的化学方程式为_______ 。
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是_______ 。
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,_______ ;
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为_______ 。
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是_______ 。
②滴定终点的现象为_______ 。
③产品的纯度为_______ (用字母表示)。
④若第三步用稀盐酸溶解,所测纯度_______ (填“偏低”“不变”或“偏高”)


(1)三颈烧瓶中发生的主要反应的化学方程式为
(2)用恒压分液漏斗盛装H2O2和浓氨水相比用普通分液漏斗盛装的好处是
(3)该反应常用冰水浴控制温度在0°C左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二,
(4)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的试剂为
(5)过氧化钙产品纯度测定实验步骤如下:
第一步:准确称取ag产品于烧杯中,加入适量的盐酸使其完全溶解;
第二步:向上述溶液中加入稍过量的(NH4)2C2O4,沉淀完全,过滤并洗涤沉淀;
第三步:将洗涤好的沉淀用稍过量的稀硫酸溶解,溶解液和洗涤液全部转移至锥形瓶中;
第四步:向锥形瓶中滴入几滴MnSO4溶液,然后逐滴滴入浓度为cmol·L-1的KMnO4溶液至终点,消耗KMnO4溶液VmL。
①滴定前,滴入MnSO4溶液的目的是
②滴定终点的现象为
③产品的纯度为
④若第三步用稀盐酸溶解,所测纯度
您最近一年使用:0次
名校
4 . 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
[实验I ]试剂:酸化的0.5mol·L-1FeSO4溶液(pH = 0.2), 5% H2O2溶液(pH = 5)
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是___________ 。
(2)产生气泡的原因是___________ 。
[实验II]试剂:未酸化的0.5mol·L-1FeSO4溶液(pH =3), 5% H2O2溶液(pH= 5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体,取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO 。检验棕黄色沉淀中SO
。检验棕黄色沉淀中SO 的方法是
的方法是___________ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设i, 理由是___________ 。
②实验验证假设ii:取___________ ,加热,溶液变为红褐色,pH下降,证明假设ii成立。
[实验III]若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II 相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(5)产生刺澉性气味气体的原因是___________ 。
(6)由实验I、II、III可知,亚铁盐与H2O2反应的现象与___________ (至少写两点)有关。
[实验I ]试剂:酸化的0.5mol·L-1FeSO4溶液(pH = 0.2), 5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡,测得反应后溶液pH= 0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是
[实验II]试剂:未酸化的0.5mol·L-1FeSO4溶液(pH =3), 5% H2O2溶液(pH= 5)
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊,测得反应后溶液pH = 1.4 |
 。检验棕黄色沉淀中SO
。检验棕黄色沉淀中SO 的方法是
的方法是(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设i, 理由是
②实验验证假设ii:取
[实验III]若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II 相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(5)产生刺澉性气味气体的原因是
(6)由实验I、II、III可知,亚铁盐与H2O2反应的现象与
您最近一年使用:0次
名校
解题方法
5 . 催化丙烯制醛的反应机理如图所示。下列说法错误的是
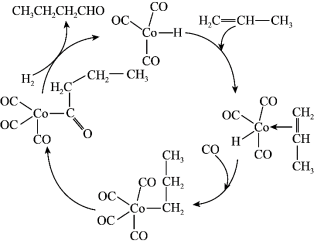

A.上述循环过程中, 的配位数发生了变化 的配位数发生了变化 |
| B.上述循环过程中,有极性键的断裂,没有非极性键的生成 |
C.丙烯醛基化总反应为 |
D.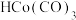 可降低丙烯醛基化反应的活化能 可降低丙烯醛基化反应的活化能 |
您最近一年使用:0次
名校
解题方法
6 . 以二氧化钛表面覆盖Cu2Al2O4为催化剂,可将CO2和CH4直接转化成乙酸,如图为反应过程中催化剂的催化效率(实线)与乙酸的生成速率(虚线)随温度的变化情况。下列说法不正确的是
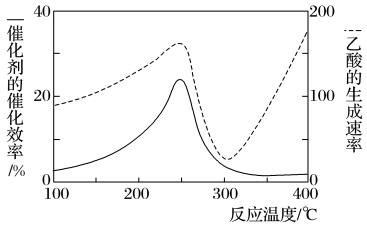

| A.该制备乙酸的反应中,原子利用率为100% |
| B.Cu2Al2O4写成氧化物的形式是Cu2O·Al2O3 |
| C.由图可知,工业上制备乙酸最适宜的温度应为250℃或者400℃ |
| D.250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低 |
您最近一年使用:0次
名校
解题方法
7 . 随着工业发展,空气污染也日益严重,其中NOx是主要污染源,最近科学家制备出了规整形貌的硫酸改性Fe2O3催化剂,该催化剂具有很好的NH3-SCR催化效果。研究表明,经过硫酸改性后的六方盘状Fe2O3催化活性和N2选择性都得到了极大的提升,催化流程如图所示。
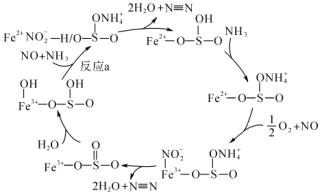
下列说法不正确的是

下列说法不正确的是
A.该反应的催化剂为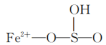 |
B.该过程可能发生的反应有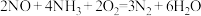 |
| C.反应a为化合反应 |
| D.硫酸改性后的六方盘状Fe2O3催化剂提高了NOx的去除率 |
您最近一年使用:0次
2021-11-19更新
|
184次组卷
|
3卷引用:福建省部分名校2021-2022学年高三上学期11月联合测评化学试题
名校
解题方法
8 . 今年9月24日,中科院的科研人员在线发表成果宣布创制了一条利用二氧化碳和电能人工合成淀粉的路线(ASAP路线):通过光伏发电电解水产生氢气,然后通过催化剂利用氢气和二氧化碳生成甲醇,使用多种优选的酶逐步将甲醇最后转化为淀粉。1立方米生物反应器年产淀粉量相当于5亩土地玉米种植的淀粉产量。下列说法错误的是
| A.ASAP路线体现了光能—电能—化学能的转变 |
| B.催化剂可以提高氢气和二氧化碳的平衡转化率 |
| C.酶在合成路线中使各步化学反应更容易发生 |
| D.ASAP路线生产在未来的发展具有广阔前景 |
您最近一年使用:0次
2021-12-06更新
|
195次组卷
|
7卷引用:福建省福清西山学校2021-2022学年高二上学期12月月考化学试题
名校
9 . 根据化学反应速率或平衡理论,联系生产实际,下列说法错误的是
| A.供热公司为了节能减排,将煤块粉碎,让煤充分燃烧 |
| B.啤酒瓶开启后,马上泛起大量泡沫,可用勒夏特列原理解释 |
| C.使用高效催化剂是大大提高原料平衡转化率的有效方法 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,利用平衡移动原理缓解病情 |
您最近一年使用:0次
2020-12-06更新
|
267次组卷
|
7卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
名校
解题方法
10 . 对反应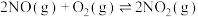 ,
,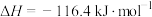 。下列说法正确的是
。下列说法正确的是
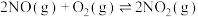 ,
,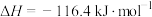 。下列说法正确的是
。下列说法正确的是A.该反应能够自发的原因 |
B.工业上使用合适的催化剂可提高 的生产效率 的生产效率 |
C.升高温度,该反应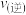 减小, 减小, 增大,平衡向逆反应方向移动 增大,平衡向逆反应方向移动 |
D.2 mol  和1 mol 和1 mol  中所含化学键能总和比2 mol 中所含化学键能总和比2 mol 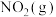 中大116.4 中大116.4  |
您最近一年使用:0次
2024-01-12更新
|
67次组卷
|
3卷引用:福建省华安县第一中学2023-2024学年高二上学期12月月考化学试题



