名校
解题方法
1 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下:
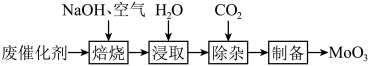
(1)焙烧。将废催化剂和足量 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、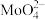 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使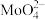 转化为
转化为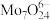 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
(5)应用。将 制成
制成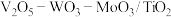 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度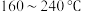 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下:
(1)焙烧。将废催化剂和足量
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、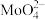 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使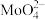 转化为
转化为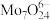 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成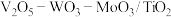 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度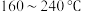 之间,
之间, 转化率不高的原因是
转化率不高的原因是
您最近一年使用:0次
2024-01-28更新
|
822次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
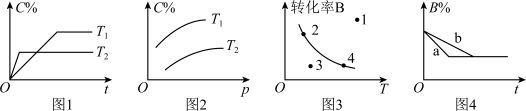
2 . 某化学研究小组探究外界条件对化学反应 的速率和平衡的影响图像如图所示。下列判断错误的是
的速率和平衡的影响图像如图所示。下列判断错误的是
 的速率和平衡的影响图像如图所示。下列判断错误的是
的速率和平衡的影响图像如图所示。下列判断错误的是
A.由图1可知,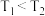 该反应正反应为放热反应 该反应正反应为放热反应 |
B.由图2可知,该反应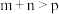 |
C.图3中,表示反应速率 的是点1 的是点1 |
D.图4中,若 ,则a曲线可能使用了催化剂 ,则a曲线可能使用了催化剂 |
您最近一年使用:0次
2023-10-14更新
|
467次组卷
|
9卷引用:湖南师范大学附属中学2022-2023学年高一下学期期末考试化学试题
湖南师范大学附属中学2022-2023学年高一下学期期末考试化学试题河南省驻马店市2022-2023学年高二上学期期末考试化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)宁夏吴忠中学2023-2024学年高二上学期期末考试化学试题陕西省宝鸡市金台区2023-2024学年高二上学期期末检测化学试题江西省宜春市宜丰中学2023-2024学年高二上学期开学考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二下学期开学考试化学试卷
3 . 某温度时,在0.5 L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
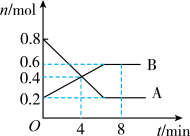
(1)该反应的化学方程式为_______ 。
(2)第4 min时,正、逆反应速率的大小关系为:v(正)_______ v(逆),(填“>”“<”或“=”)。
(3)下列措施能加快反应速率的是_______。

(1)该反应的化学方程式为
(2)第4 min时,正、逆反应速率的大小关系为:v(正)
(3)下列措施能加快反应速率的是_______。
| A.恒温恒容充入He气 | B.缩小体积,使压强增大 |
| C.恒温恒压充入He气 | D.使用催化剂 |
您最近一年使用:0次
名校
4 . 一定条件下的恒容密闭容器中,发生可逆反应: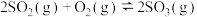 。下列说法错误的是
。下列说法错误的是
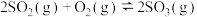 。下列说法错误的是
。下列说法错误的是| A.SO2不可能100%地转化为SO3 |
| B.当混合气体密度保持不变时,可判定该可逆反应达到平衡状态 |
| C.使用催化剂可增大反应速率,提高生产效率 |
| D.升高温度,该反应正反应速率和逆反应速率均增大 |
您最近一年使用:0次
名校
解题方法
5 . 铁的配合物离子催化某反应的一种反应机理和相对能量的变化情况如图所示
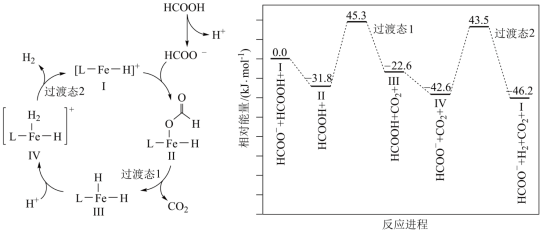
| A.总反应速率由Ⅳ→Ⅰ决定 |
B. 浓度过大会导致反应Ⅰ→Ⅱ速率加快 浓度过大会导致反应Ⅰ→Ⅱ速率加快 |
| C.该过程中铁的配合物离子催化剂不能提高平衡转化率 |
D.总反应为 |
您最近一年使用:0次
2023-07-05更新
|
365次组卷
|
3卷引用:湖南省怀化市2022-2023学年高二下学期期末考试化学试题
解题方法
6 . 某些物质间的转化关系如图所示。下列说法错误的是
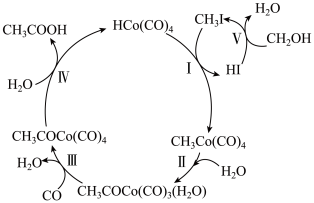

| A.该转化关系的总反应原子利用率为100% |
B.HI、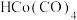 是该转化过程中的催化剂 是该转化过程中的催化剂 |
| C.Ⅳ的反应类型为取代反应 |
| D.转化过程中有非极性键的断裂和生成 |
您最近一年使用:0次
名校
解题方法
7 . 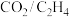 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是

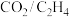 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
| A.由步骤①②知:加成反应也可生成酯类物质 |
| B.反应过程中存在C-H键的断裂 |
| C.该反应的原子利用率为100% |
D.若将步骤②中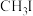 换为 换为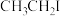 ,则产品将变为丙烯酸乙酯 ,则产品将变为丙烯酸乙酯 |
您最近一年使用:0次
2023-05-04更新
|
412次组卷
|
4卷引用:湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题
湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题福建省福州第一中学2022-2023学年高二下学期期末考试化学试题福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
8 . 如图所示为工业合成氨的流程图。下列有关说法不正确的是
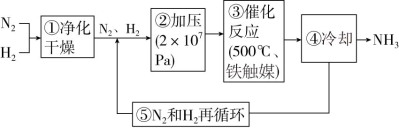

| A.步骤①中“净化”的目的是防止催化剂中毒 |
| B.步骤②中“加压”既可提高原料的转化率,又可加快反应速率 |
| C.步骤③中“500℃、铁触媒”有利于提高原料的平衡转化率 |
| D.步骤④中“冷却”的目的是将氨液化分离出来,提高原料的转化率 |
您最近一年使用:0次
2023-02-19更新
|
171次组卷
|
3卷引用:湖南省永州市2022-2023学年高二上学期期末考试化学试题
湖南省永州市2022-2023学年高二上学期期末考试化学试题(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题
解题方法
9 . 在恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是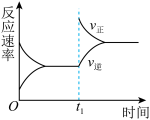
| A.升高温度 | B.加入催化剂 |
| C.充入一定量的氧气 | D.充入一定量的氦气 |
您最近一年使用:0次
2023-02-13更新
|
820次组卷
|
5卷引用:湖南省益阳市2020-2021学年高二上学期期末考试化学试题
湖南省益阳市2020-2021学年高二上学期期末考试化学试题(已下线)专题一 化学反应速率图象(讲)课时2影响化学反应速率的因素课堂例题(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)提升练04 化学平衡图像分析-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
10 . 随着经济的发展,能源与环境问题越来越受到人们的重视和关注,资源利用和环境保护是当前重要研究课题,回答下列问题:
(1)合成气( 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
则反应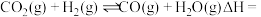
_______  (用含a、b代数式表示),
(用含a、b代数式表示),
_______ 0(填“>”或“<”)。
(2)科学家提出利用 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示:
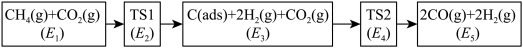
注: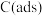 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。
若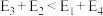 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为_______ 。
(3)一定条件下,向密闭容器中通入一定量的 和
和 制备甲醇,投料比
制备甲醇,投料比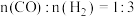 ,反应为
,反应为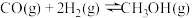 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
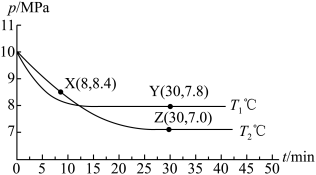
①X点的逆反应速率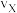 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率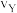 (正)的大小关系:
(正)的大小关系: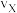 (逆)
(逆)_______ 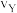 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。
②图中Z点的压强平衡常数
_______ 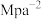 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
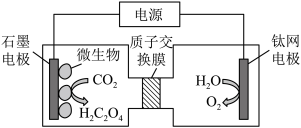
阴极区电极反应式为_______ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_______ 。装置工作时,阴极区除生成 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为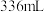 时,测得左池
时,测得左池 的物质的量为
的物质的量为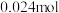 ,则电解效率为
,则电解效率为_______ 。
(1)合成气(
 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:| 热化学方程式 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
Ⅰ.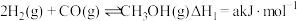 |  | 2.50 | 0.340 | 0.150 |
Ⅱ.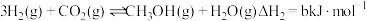 |  | 2.50 | 0.578 | 0.378 |
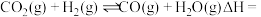
 (用含a、b代数式表示),
(用含a、b代数式表示),
(2)科学家提出利用
 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示: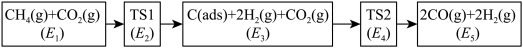
注:
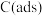 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。若
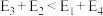 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为(3)一定条件下,向密闭容器中通入一定量的
 和
和 制备甲醇,投料比
制备甲醇,投料比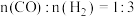 ,反应为
,反应为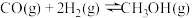 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
①X点的逆反应速率
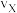 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率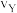 (正)的大小关系:
(正)的大小关系: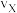 (逆)
(逆)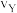 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。②图中Z点的压强平衡常数

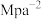 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
阴极区电极反应式为
 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为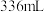 时,测得左池
时,测得左池 的物质的量为
的物质的量为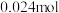 ,则电解效率为
,则电解效率为
您最近一年使用:0次
2023-02-11更新
|
112次组卷
|
2卷引用:湖南省怀化市2022-2023学年高二上学期期末考试化学试题



