1 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
(1)实验1、2的目的是研究__________ 因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________ 。
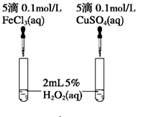
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________ 得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________ 。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______ 。
(3)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________ 。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________ mol·L-1·min-1。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
(1)实验1、2的目的是研究
(2)实验1对应的化学方程式为
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是
(3)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=
您最近一年使用:0次
2018高三上·全国·专题练习
2 . CO、CO2的转化和利用是环境化学研究的热点课题。
(1)已知:CO的燃烧热为-283.0 kJ·mol1。CO(g)+O2(g) CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
则2O(g) O2(g) ΔH=
O2(g) ΔH=_________ kJ·mol1。
(2)沥青混凝土可作为反应2CO(g)+O2(g) 2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
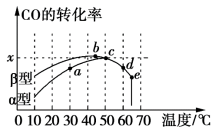
①a、b、c、d 四点中,未达到平衡状态的点是_________________ (填字母代号)。d点对应的转化率比b点低,其主要原因是___________________________ 。
②在均未达到平衡状态时,同温度下对上述反应催化效率较高的是_________ (填“α”或“β”)型沥青混凝土。e点CO的转化率突变,其可能的原因是___________________________ 。
③已知c点时容器中O2浓度为0.04 mol·L1,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________ (用含x的代数式表示)。
(3)CO也是一种燃料。CO-空气碱性(KOH为电解质)燃料电池中,正极区充入_________ (填“CO”或“空气”);若在放电过程中恰好生成KHCO3,写出此时负极的电极反应式:__________________ 。
(1)已知:CO的燃烧热为-283.0 kJ·mol1。CO(g)+O2(g)
 CO2(g) +O(g) ΔH=-33.5 kJ·mol1,
CO2(g) +O(g) ΔH=-33.5 kJ·mol1,则2O(g)
 O2(g) ΔH=
O2(g) ΔH=(2)沥青混凝土可作为反应2CO(g)+O2(g)
 2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
2CO2(g)的催化剂。在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系如图所示。
①a、b、c、d 四点中,未达到平衡状态的点是
②在均未达到平衡状态时,同温度下对上述反应催化效率较高的是
③已知c点时容器中O2浓度为0.04 mol·L1,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=
(3)CO也是一种燃料。CO-空气碱性(KOH为电解质)燃料电池中,正极区充入
您最近一年使用:0次
解题方法
3 . 研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________ 。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________ 。
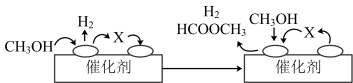
②写出ⅱ(分解)反应的化学方程式____________ 。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________ 。
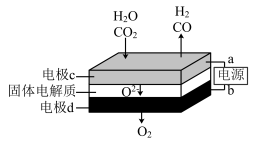
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________ 、_________ 。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
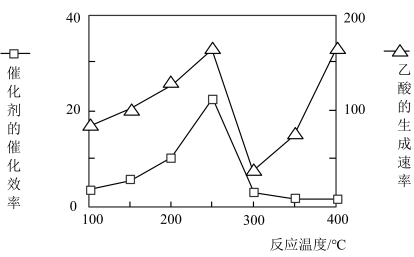
在250-300℃过程中影响速率的主要因素是___________ ;在300-400℃过程中影响速率的主要因素是___________ 。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH
 HCOOCH3 + 2H2
HCOOCH3 + 2H2ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为

②写出ⅱ(分解)反应的化学方程式
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:

(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。

在250-300℃过程中影响速率的主要因素是
您最近一年使用:0次
名校
4 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol /L的溶液。在FeCl2溶 液中需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________ 。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1 mol/LFeCl3溶液混合。 分别取2 mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______ (填离子符号);实验①和实验③说明:在I-过量的情况下, 溶液中仍含有_____ (填离子符号);由此可以证明该氧化还原反应为___________ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________ 。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________ 。 生成沉淀的原因是______________ (用平衡移动原理解释)。
(6)某铁的氧化物(FexO) 1.52 g溶于足量盐酸中,向所得溶液通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化,则x值为________ 。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol /L的溶液。在FeCl2溶 液中需加入少量铁屑,其目的是
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1 mol/LFeCl3溶液混合。 分别取2 mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
(6)某铁的氧化物(FexO) 1.52 g溶于足量盐酸中,向所得溶液通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化,则x值为
您最近一年使用:0次
2018-06-02更新
|
181次组卷
|
2卷引用:【全国区级联考】天津市南开区2018届高三三模化学试题
名校
解题方法
5 . 实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:

(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_________ 。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式_________ 。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是_________ 。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________ 。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是________ 。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_________ 。

(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入
您最近一年使用:0次
2018-05-30更新
|
1324次组卷
|
3卷引用:【全国校级联考】江苏省南京市金陵中学、海安高级中学、南京外国语学校2018届高三第四次模拟考试化学试题
6 . 近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
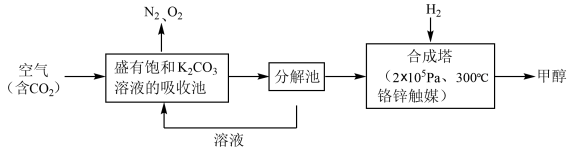
回答下列问题:
(1)进入分解池中主要物质是______ ;在合成塔中,若足量的H2与CO2反应,消耗4.4gCO2,生成气态的H2O和CH3OH,可放出5370J的热量,写出该反应的热化学方程式________ 。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①_______ ;②_______ 。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:
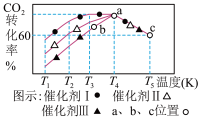
①催化剂效果最佳的是_______ (填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______ v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________ 。c点时该反应的平衡常数K=___________ (保留一位小数)。
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为_________ 。

(5)已知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3-+H2O H2CO3+ OH-的平衡常数K=
H2CO3+ OH-的平衡常数K=________ 。

回答下列问题:
(1)进入分解池中主要物质是
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的是
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为

(5)已知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3-+H2O
 H2CO3+ OH-的平衡常数K=
H2CO3+ OH-的平衡常数K=
您最近一年使用:0次
名校
解题方法
7 . 铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。
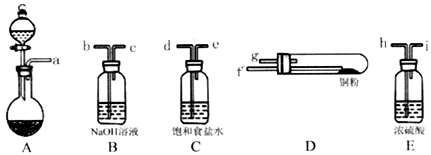
①按气流方向连接各仪器接口顺序是:
a→_____ 、_____ →_____ 、_____ →_____ 、_____ →_____ 。
②本套装置有两个仪器需要加热,加热的顺序为先_____ 后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________ 。
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____ 、_____ 、洗涤、干燥。
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是______________ 。
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:_____ 。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)

(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。

①按气流方向连接各仪器接口顺序是:
a→
②本套装置有两个仪器需要加热,加热的顺序为先
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:
您最近一年使用:0次
2018-04-22更新
|
430次组卷
|
2卷引用:内蒙古赤峰市2018届高三4月模拟理科综合化学试题
解题方法
8 . 三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4)。再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
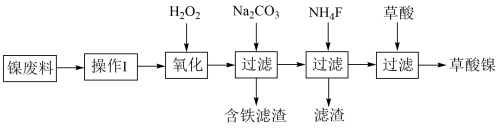
请回答下列问题:
(1)操作I为____ 。加入H2O2发生的主要反应的离子方程式为_____ ;加入碳酸钠溶液调节pH至4.0-5.0,其目的为______ 。
(2)若加入NH4F时滤液中c(Mg2+)=0.02mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___ 。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____ 。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____ 。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____ 。
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____ 。


请回答下列问题:
(1)操作I为
(2)若加入NH4F时滤液中c(Mg2+)=0.02mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是

您最近一年使用:0次
9 . 已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。
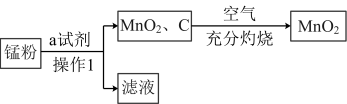
(1)某同学认为试剂a为蒸馏水,你认为______ (填“能”或“不能”)实现实验目的。
(2)操作1的名称是______ ,所用到的玻璃仪器有烧杯、玻璃棒和______ 。
(3)在空气中充分灼烧的目的是_________ 。
二氧化锰的性质检验:
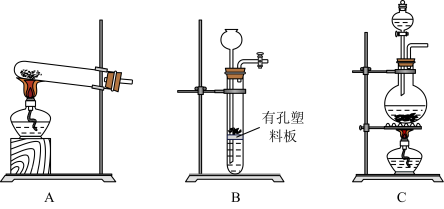
Ⅰ.氧化性
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是______ (填字母)。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为_______ 。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为______ 。

Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
(7)本实验的待测数据是___________ 。
(8)由实验①和②可得出的结论是______________________ 。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。

(1)某同学认为试剂a为蒸馏水,你认为
(2)操作1的名称是
(3)在空气中充分灼烧的目的是
二氧化锰的性质检验:
Ⅰ.氧化性
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是

(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为

Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
| 实验序号 | w(H2O2)/% | 粉状MnO2/g | 温度/℃ | 待测数据 |
| ① | 5 | 0 | 20 | |
| ② | 5 | 1.0 | 20 |
(8)由实验①和②可得出的结论是
您最近一年使用:0次
名校
解题方法
10 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)H2O2的电子式是___________ 。
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii_______________ (用热化学方程式表示)。
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是________ 。
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。_________

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
实验Ⅰ的目的是______________ ,由实验(3)可得出的结论是________________ 。
(1)H2O2的电子式是
(2)趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:i.H2O2(l)+I-(aq)==== H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+________________________________。
① 2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,补全反应ii
② 某小组在研究影响H2O2分解速率的因素时得到图1的数据关系,由此得出的结论是
③ 已知:i的反应速率小于ii的反应速率,在图2画出H2O2溶液中加入KI后,“反应过程—能量”示意图。

(3)为分析不同试剂是否对H2O2分解有催化作用,该小组向四支盛有10mL5% H2O2的试管中滴加不同溶液,实验记录如下:
| 试管 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
滴加试剂 | 2滴1mol/L NaCl | 2滴1mol/L CuSO4 | 2滴1mol/L CuSO4 和2滴1mol/L NaCl | 2滴1mol/L CuSO4 和4滴1mol/L NaCl |
| 产生气泡情况 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅱ到Ⅳ依次加快 | ||
您最近一年使用:0次
2018-01-25更新
|
312次组卷
|
2卷引用:北京市石景山区2018届高三第一学期期末考试化学试题



