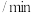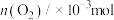解题方法
1 . 甲醇( )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示:
 )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示: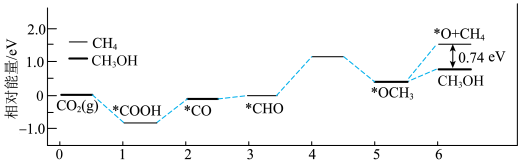
A.生成甲醇反应的决速步为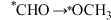 |
| B.两反应只涉及极性键的断裂和生成 |
| C.通过上图分析:甲烷比甲醇稳定 |
D.用 作催化剂可提高甲醇的选择性 作催化剂可提高甲醇的选择性 |
您最近一年使用:0次
名校
2 . 某学习小组利用5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4(一种弱酸)溶液,然后倒入大试管中迅速振荡,通过测定褪色所需时间来判断反应的快慢。
(1)下列因素能加快该反应速率的是___________。
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)___________ 。
(3)甲同学设计了如下实验
①探究温度对化学反应速率影响的组合实验编号是___________ 。
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。___________

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=___________ (保留3位有效数字)。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:___________ 。
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或 该反应有催化作用
该反应有催化作用
丙同学认为假设4不合理,其理由是___________ 。
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入___________ mL蒸馏水,然后在两支试管中同时分别加入1mL0.1mol·L-1KMnO4酸性溶液。预期的实验现象是___________ 。在B试管中加入蒸馏水的目的是___________ 。同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)___________ 。
(1)下列因素能加快该反应速率的是___________。
| A.加入少量K2SO4固体 | B.加入少量NaCl固体 |
| C.增大压强 | D.加入少量Na2C2O4固体 |
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如下实验
| 实验 编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | 褪色时间/s | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| a | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| b | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| c | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或
 该反应有催化作用
该反应有催化作用丙同学认为假设4不合理,其理由是
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入
您最近一年使用:0次
名校
解题方法
3 . 为使CO2的利用更具价值,某研究小组设计了如下三种减碳方式。请按要求回答下列问题。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为___________ 。
②在重整系统中的还原剂为:___________ 。
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):
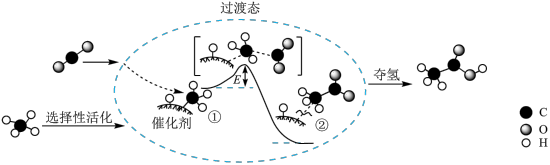
①该催化总反应为___________ 。
②Ⅰ→Ⅲ反应的
___________ kJ/mol。
(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。

①该反应的
___________ 0(填“>”“<”或“不能确定”)。
②200℃,5min达平衡,v(C2H4)=___________ ;CO2的平衡转化率为___________ ;该反应平衡常数的值为___________ 。
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将___________ (填“增大”“减小”或“不变),判断理由是 ___________ 。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为
②在重整系统中的还原剂为:
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):

①该催化总反应为
②Ⅰ→Ⅲ反应的

(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
①该反应的

②200℃,5min达平衡,v(C2H4)=
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将
您最近一年使用:0次
4 .  的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。
Ⅰ.热化学法处理 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是___________ 。
(2)该反应的正逆反应速率可分别表示为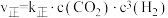 ,
,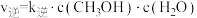 ,其中
,其中 、
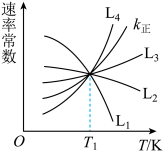
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“ ”或“
”或“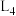 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在 下,将
下,将 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________  。
。
(4)实际合成反应时,也会有 等生成。在恒压条件下
等生成。在恒压条件下 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:

①合成 最适宜的温度为
最适宜的温度为___________
②在 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是___________ 。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
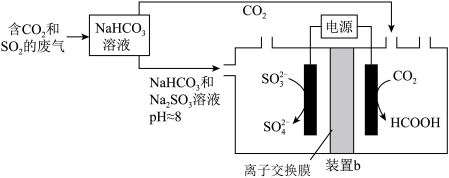
(5)反应后装置b中溶液
___________ (填“增大”、“减小”或“不变”),装置b中的总反应的离子方程式为___________ 。
 的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。Ⅰ.热化学法处理
 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是
(2)该反应的正逆反应速率可分别表示为
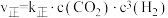 ,
,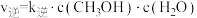 ,其中
,其中 、
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为 ”“
”“ ”“
”“ ”或“
”或“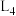 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在
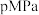 下,将
下,将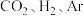 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
 。
。(4)实际合成反应时,也会有
 等生成。在恒压条件下
等生成。在恒压条件下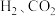 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:
①合成
 最适宜的温度为
最适宜的温度为②在
 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(5)反应后装置b中溶液

您最近一年使用:0次
5 . 一定温度下,在2.0L密闭容器中加入纳米级 并通入
并通入 ,发生反应:
,发生反应: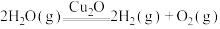
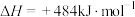 ,不同时间产生
,不同时间产生 的物质的量见下表,下列说法错误的是
的物质的量见下表,下列说法错误的是
 并通入
并通入 ,发生反应:
,发生反应: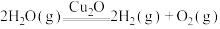
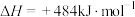 ,不同时间产生
,不同时间产生 的物质的量见下表,下列说法错误的是
的物质的量见下表,下列说法错误的是时间 | 20 | 40 | 60 | 80 |
| 1.0 | 1.6 | 2.0 | 2.0 |
A.使用纳米级 ,可以增大平衡时氧气的体积分数 ,可以增大平衡时氧气的体积分数 |
B.达到平衡时,至少需要从外界吸收能量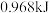 |
C.增大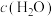 ,可以改变反应的限度 ,可以改变反应的限度 |
D.前20min的平均反应速率 |
您最近一年使用:0次
名校
6 . 可逆反应aA(g)+bB(s)⇌cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
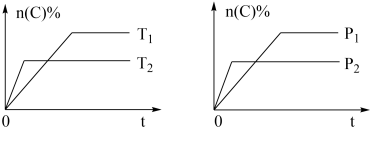

| A.升高温度,平衡向逆反应方向移动 |
| B.使用催化剂,C的物质的量分数增加 |
| C.化学方程式系数a>c+d |
| D.达到平衡后,P1条件V逆反应速率大于P2条件下V正反应速率 |
您最近一年使用:0次
解题方法
7 . 一定条件下合成乙烯; 。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是

 。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
| A.M点时平衡常数比N点时平衡常数小 |
B.若投料比 ,则图中M点乙烯的体积分数约为5.88% ,则图中M点乙烯的体积分数约为5.88% |
C.若该反应不使用催化剂,则M点的 大于N点的 大于N点的 |
| D.当温度高于250℃,由于升高温度导致催化剂的催化效率而使降低平衡逆向移动 |
您最近一年使用:0次
名校
8 . 甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成 和
和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是

 和
和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说法错误的是
| A.途径一与途径二甲酸平衡转化率相同 |
B. |
C.途径二 参与反应,通过改变反应途径,降低反应的活化能,加快反应速率 参与反应,通过改变反应途径,降低反应的活化能,加快反应速率 |
D.途径二反应的快慢由生成 的速率决定 的速率决定 |
您最近一年使用:0次
名校
解题方法
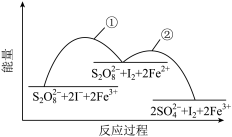
9 . 已知反应S2O (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法正确的是
| A.反应①②均为放热反应 |
| B.Fe2+是该反应的催化剂 |
| C.增大Fe3+浓度,能够加快反应速率 |
| D.若不加Fe3+,正反应的活化能比逆反应的活化能大 |
您最近一年使用:0次
名校
10 . 某反应的反应机理可以分成如下两步,下列说法错误的是
| 反应机理 | 第一步反应 | 第二步反应 |
 (慢反应) (慢反应) | 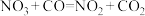 (快反应) (快反应) |
| A.在条件相同时,该反应的速率由第一步反应速率决定 |
| B.该反应的总反应方程式为NO2+CO=NO+CO2 |
| C.升高温度只会影响第一步反应速率,对第二步反应速率无影响 |
| D.加入合适的催化剂可降低反应的活化能,加快反应速率 |
您最近一年使用:0次
2024-01-01更新
|
143次组卷
|
12卷引用:四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题
四川省兴文第二中学校2023-2024学年高二上学期11月期中考试化学试题陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷 湖北省武汉市新洲区第一中学2024届高二上学期11月阶段测试化学试题安徽省A10联盟2022届高三上学期摸底考试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期中考试化学(理)试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)2021年广东省高考化学试卷变式题11-21吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题湖北省武汉市部分学校2021-2022学年高二上学期12月联考化学试题(已下线)专题02 化学反应速率-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期1月考试化学试题