1 . 可逆反应NO2(g)+CO(g) CO2(g)+NO(g)反应过程中的能量变化如图所示,下列说法正确的是
CO2(g)+NO(g)反应过程中的能量变化如图所示,下列说法正确的是
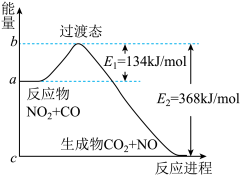
 CO2(g)+NO(g)反应过程中的能量变化如图所示,下列说法正确的是
CO2(g)+NO(g)反应过程中的能量变化如图所示,下列说法正确的是
| A.因为该反应△H<0,反应的反应物总能量小于生成物总能量 |
| B.若反应开始时加入催化剂,则使E1、E2 都减小 |
| C.正反应的活化能是368 kJ/mol |
| D.1molNO2与1molCO混合经充分反应放热234kJ |
您最近半年使用:0次
2 . 下列关于有效碰撞理论与影响速率因素之间关系正确的是
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 |
| C.温度升高,反应所需活化能减少,反应速率增大 |
| D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 |
您最近半年使用:0次
3 . 下图是我国科研工作者研究MgO(s)与CH4(g)作用最终生成Mg(s)与CH3OH (g)的物质相对能量-反应进程曲线。下列叙述错误的是
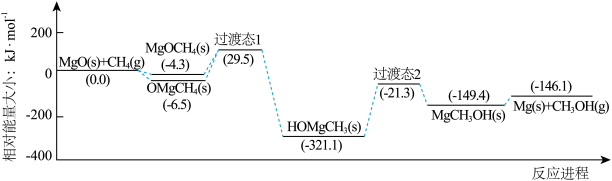

| A.中间体OMgCH4(s)比MgOCH4(s)更稳定 |
| B.MgCH3OH(s)→Mg(s)+CH3OH(g)的速率决定总反应的速率 |
| C.生成HOMgCH3(s)的过程中有极性键的断裂和形成 |
| D.总反应的热化学方程式为MgO(s)+CH4(g)=Mg(s)+CH3OH (g) ΔH= -146.1kJ·mol-1 |
您最近半年使用:0次
4 . 某化学兴趣小组,利用NaHSO3溶液和酸性KMnO4溶液(使用稀H2SO4酸化)反应探究外界因素对化学反应速率的影响。
Ⅰ.原理分析:
(1)反应过程中 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式_______________ 。
(2)实验过程中,NaHSO3的用量要保证足量,通过比较________ (填“实验现象”)所需时间的长短来判断反应的快慢。
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
(3)对比实验①②,使用探究________ 对化学反应速率的影响;若实验②③是用来探究温度对化学反应速率的影响,则V1=________ mL。
(4)若t1=25s,则用HSO 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= ________ 。
Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
(5)为了实验结论的可靠性,试剂X应该选择________。
(6)实验后,若t4_____ t1(填“大于”、“小于”或 “等于”),说明猜想2成立。
Ⅰ.原理分析:
(1)反应过程中
 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式(2)实验过程中,NaHSO3的用量要保证足量,通过比较
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.6mol/L NaHSO3溶液 | 0.2mol/L酸性KMnO4溶液 | 水 | |||
| ① | 25 | 20 | 20 | 10 | t1 |
| ② | 25 | 25 | 20 | 5 | t2 |
| ③ | 50 | V1 | 20 | 5 | t3 |
(3)对比实验①②,使用探究
(4)若t1=25s,则用HSO
 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.5mol/L NaHSO3溶液 | 0.2mol/L 酸性KMnO4溶液 | 试剂X | |||
| ④ | 25 | 20 | 20 | 10 | t4 |
(5)为了实验结论的可靠性,试剂X应该选择________。
| A.MnCl2溶液 | B.MnSO4溶液 |
| C.Mn(NO3)2溶液 | D.Mn(HSO3)2溶液 |
(6)实验后,若t4
您最近半年使用:0次
5 . 制造水煤气时发生可逆反应C(s)+H2O(g) CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
 CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是
CO(g)+H2(g) ΔH >0,下列措施既能提高化学反应速率,又能提高平衡转化率的是| A.增大压强 | B.升高温度 | C.增大C的用量 | D.加入催化剂 |
您最近半年使用:0次
解题方法
6 . 中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的,反应过程示意图如下:
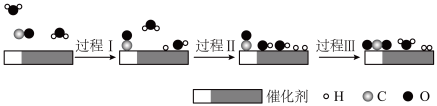
下列说法正确 的是

下列说法
| A.过程Ⅰ和过程Ⅲ均为放热过程 |
| B.图示过程中的3个过程都涉及到了H2O |
| C.过程Ⅲ生成了具有极性共价键的H2、CO2 |
| D.使用催化剂缩小反应物和生成物的能量差 |
您最近半年使用:0次
7 . N2O是温室气体之一、CO和N2O在Fe+作用下转化为N2和CO2,反应的能量变化及反应历程如图所示,两步基元反应为:①Fe++N2O=N2+FeO+、K1,②FeO++CO=Fe++CO2、K2。下列说法正确的是
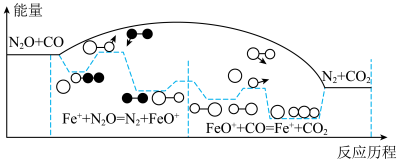

| A.该反应△H>0 |
| B.升高温度,将降低N2O的平衡转化率 |
| C.两步反应中,决定总反应速率的是反应② |
| D.Fe+既改变反应历程,也改变了反应的△H |
您最近半年使用:0次
2024-03-08更新
|
74次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
名校
8 . 为克服传统的甲烷水蒸气重整制氢工艺中产生积碳和过多CO的缺点,科学家提出将传统的甲烷水蒸气重整分两步进行,即CH4催化裂解和催化剂消碳再生交替进行的循环制氢工艺(原理如图所示)。下列说法错误的是
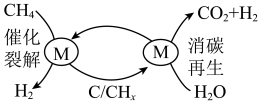

A.消碳再生过程涉及的反应之一为C+2H2O CO2+2H2 CO2+2H2 |
| B.更换合适的催化剂,降低反应焓变,效果更好 |
| C.每消耗1molCH4最多可产生4molH2 |
| D.CHx为中间产物 |
您最近半年使用:0次
2024-01-15更新
|
189次组卷
|
3卷引用:2024届贵州省黔东南苗族侗族自治州高三上学期12月一模化学试题
9 . 皓矾(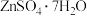 )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。

回答下列问题:
(1)基态锌原子价层电子排布式为___________ ;S、O、Si三种元素中,第一电离能最大的是___________ 。
(2)“酸浸”时, 和
和 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是___________ 。
(4)“滤渣2”为黄钠铁矾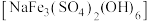 沉淀,产生该沉淀的离子方程式为
沉淀,产生该沉淀的离子方程式为___________ 。
(5)若“净化”时,将除去 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是___________ (填化学式)。
(6)该工艺产生的废液中含有 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节pH,再通入
组成的缓冲溶液调节pH,再通入 发生反应:
发生反应: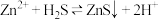 。
。
处理后的废液中部分微粒浓度如下:
则a=___________ ,该废水___________ (填“能”或“不能”)排放。
已知:常温下, ,
,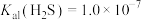 ,
, ,
, 。当c(Zn2+)≤1.0×10-5mol/L时认为废水可以排放。
。当c(Zn2+)≤1.0×10-5mol/L时认为废水可以排放。
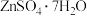 )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
回答下列问题:
(1)基态锌原子价层电子排布式为
(2)“酸浸”时,
 和
和 反应的离子方程式为
反应的离子方程式为(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是
(4)“滤渣2”为黄钠铁矾
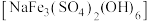 沉淀,产生该沉淀的离子方程式为
沉淀,产生该沉淀的离子方程式为(5)若“净化”时,将除去
 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是(6)该工艺产生的废液中含有
 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节pH,再通入
组成的缓冲溶液调节pH,再通入 发生反应:
发生反应: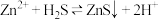 。
。处理后的废液中部分微粒浓度如下:
| 微粒 |  |  | 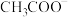 |  |
| 浓度/(mol/L) | 0.2 | 0.1 | 0.2 | a |
已知:常温下,
 ,
, ,
, ,
, 。当c(Zn2+)≤1.0×10-5mol/L时认为废水可以排放。
。当c(Zn2+)≤1.0×10-5mol/L时认为废水可以排放。
您最近半年使用:0次
名校
10 . 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如下图所示。下列说法不正确 的是
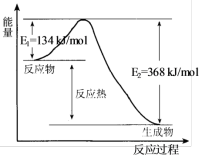

| A.该反应是放热反应 |
| B.该反应的反应热△H=-234kJ/mol |
| C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小 |
D.由图可推出:NO(g)+CO2(g)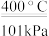 NO2(g)+CO(g) △H=+234kJ/mol NO2(g)+CO(g) △H=+234kJ/mol |
您最近半年使用:0次



