名校
解题方法
1 . 实验室模拟尿素法制备水合肼(N2H4·H2O)的流程如下:
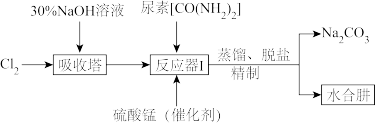
已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(2)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。

①双极膜中产生的_______ (填“H+”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应: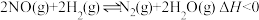 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
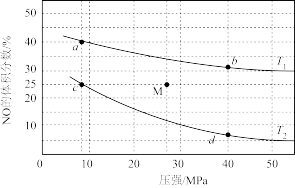
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点_______ 。

已知:①N2H4·H2O易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,将NaClO和NaOH的碱性混合溶液与尿素溶液反应生成N2H4·H2O。
回答下列问题:
(1)写出反应器1中生成水合肼反应的化学方程式:
(2)反应器1要控制NaClO溶液的用量,其主要目的是
(3)某实验室设计了如图所示装置制备N2H4。双极膜是阴、阳复合膜,层间的H2O解离成
 和H+并可分别通过阴、阳膜定向移动。
和H+并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
(4)NO可被联氨(N2H4)或H2还原为N2,若在密闭容器中充入4molNO和5molH2,发生反应:
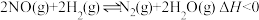 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率 C. N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点
您最近一年使用:0次
2 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向 溶液中滴加 溶液中滴加 溶液,再滴加几滴 溶液,再滴加几滴 溶液。观察溶液颜色变化 溶液。观察溶液颜色变化 |  和 和 的反应为可逆反应 的反应为可逆反应 |
| B | 向盛有少量酸性 溶液的试管中滴加足量乙醇,充分振荡,观察溶液颜色变化 溶液的试管中滴加足量乙醇,充分振荡,观察溶液颜色变化 | 乙醇具有还原性 |
| C | 向溶有 的 的 溶液中通入气体X,出现白色沉淀 溶液中通入气体X,出现白色沉淀 | 气体X具有强氧化性 |
| D | 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入酸性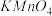 溶液中,溶液褪色 溶液中,溶液褪色 | 溴乙烷发生了取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 由下列实验操作及现象得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 取 溶液于试管中,加入 溶液于试管中,加入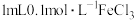 溶液,充分反应后滴入5滴15%KSCN溶液 溶液,充分反应后滴入5滴15%KSCN溶液 | 溶液变血红色 | KI与 的反应有一定限度 的反应有一定限度 |
| B | 向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口 | 石蕊试纸不变蓝 | 溶液X中肯定不含 |
| C | 将硫酸酸化的 溶液滴入 溶液滴入 溶液中 溶液中 | 溶液变黄色 | 氧化性: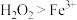 (酸性条件) (酸性条件) |
| D | 向一定浓度的 溶液中通入适量 溶液中通入适量 气体 气体 | 产生黑色沉淀 |  的酸性比 的酸性比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-16更新
|
698次组卷
|
8卷引用:辽宁省县级重点高中联合体2022-2023学年高三上学期期中考试化学试题
13-14高二下·吉林长春·期末
名校
4 . 某实验小组依据反应 设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )

 设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 3-氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
| A.调节pH可以改变反应的方向 |
| B.pH=0.68时,反应处于平衡状态 |
| C.pH=5时, 负极电极反应式为2I--2e -= I2 |
| D.pH>0.68时,氧化性I2>AsO43- |
您最近一年使用:0次
2016-12-09更新
|
397次组卷
|
6卷引用:2015-2016学年辽宁沈阳二中高一6月月考化学试卷
名校
5 . 常温常压下肼(N2H4)是一种易溶于水的无色油状液体,具有强还原性,在工业生产中有广泛应用。
(1)发射卫星时,可用肼作燃料,NO2作氧化剂,当12.8g气态肼和NO2完全反应生成氮气和水蒸气时,放出227.14kJ的热量,则该反应中氧化产物和还原产物的物质的量之比为_______ ,1mol气态肼参与该反应,放出的热量为_______ 。
(2)液态肼、空气、KOH溶液构成的燃料电池的装置如图所示。

①a电极的电极反应式为_______ 。
②不考虑溶解等损失,当电池中消耗12.8g液态肼,需通入标准状况下空气(假设空气中氧气的体积分数为20%)的体积约为_______ 。
(3)向1 L的恒容容器中加入0.1mol液态肼,在303K、Pt催化下发生反应N2H4(l) N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中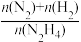 随时间的变化情况如图所示。
随时间的变化情况如图所示。

①下列能表明该反应达到平衡状态的是_______ (填字母序号)。
a.相同时间内,断裂4 mol N—H键的同时,断裂1 mol N≡N键
b.容器内气体的密度不再变化
c.容器内混合气体的平均相对分子质量不再变化
d.容器内n(N2H4):n(N2):n(H2)=1:1:2
e.容器内混合气体的压强不再变化
②为加快液态肼的分解速率,下列可采取的措施为_______ (填字母序号)。
a.升高温度 b.将容器的体积压缩至0.5 L c.向容器中再加入0.1mol液态肼 d.移走生成的H2 e.充入0.1molHe,使容器压强增大
③4min时,若改变条件使2v正(N2)>v逆(H2),则平衡被打破,反应_______ (填“正”或“逆”)向进行。
④0~4min内用H2表示的平均反应速率为_______ 。
(1)发射卫星时,可用肼作燃料,NO2作氧化剂,当12.8g气态肼和NO2完全反应生成氮气和水蒸气时,放出227.14kJ的热量,则该反应中氧化产物和还原产物的物质的量之比为
(2)液态肼、空气、KOH溶液构成的燃料电池的装置如图所示。

①a电极的电极反应式为
②不考虑溶解等损失,当电池中消耗12.8g液态肼,需通入标准状况下空气(假设空气中氧气的体积分数为20%)的体积约为
(3)向1 L的恒容容器中加入0.1mol液态肼,在303K、Pt催化下发生反应N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中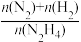 随时间的变化情况如图所示。
随时间的变化情况如图所示。
①下列能表明该反应达到平衡状态的是
a.相同时间内,断裂4 mol N—H键的同时,断裂1 mol N≡N键
b.容器内气体的密度不再变化
c.容器内混合气体的平均相对分子质量不再变化
d.容器内n(N2H4):n(N2):n(H2)=1:1:2
e.容器内混合气体的压强不再变化
②为加快液态肼的分解速率,下列可采取的措施为
a.升高温度 b.将容器的体积压缩至0.5 L c.向容器中再加入0.1mol液态肼 d.移走生成的H2 e.充入0.1molHe,使容器压强增大
③4min时,若改变条件使2v正(N2)>v逆(H2),则平衡被打破,反应
④0~4min内用H2表示的平均反应速率为
您最近一年使用:0次
名校
6 . 下列操作能实现相应的实验目的的是
| 选项 | 实验目的 | 操作步骤及现象 |
| A | 证明HA是强酸 | 加入酚酞做指示剂,用同浓度的烧碱溶液滴定,终点消耗烧碱溶液体积与HA相同 |
| B | 证明H2与I2(g)的反应为可逆反应 | 将物质的量之比为2:1的H2与I2(g)混合气体在一定条件下充分反应,混合气体呈紫色 |
| C | 证明麦芽糖能水解 | 向麦芽糖溶液中加稀硫酸并加热,冷却后加入烧碱中和过量硫酸再加入银氨溶液加热,析出银镜 |
| D | 证明氧化性: | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中,再滴入KSCN溶液,溶液变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
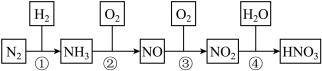
7 . 硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,它也是一种重要的化工原料。氨氧化法生产硝酸是世界上生产硝酸的主要方法,其制备过程如图所示,回答下列问题:
(2)将装有50mLNO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是_______ 。
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:_______ 。
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:_______ ,该反应_______ (填“吸热”或“放热”)。 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
①下列情况不能 说明N2与H2反应一定达到化学平衡状态的是_______ (填标号)。
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则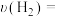
_______ mol·L-1·min-1。
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是_______  。
。
| A. NO2易溶于水生成HNO3,故NO2是酸性氧化物 |
| B.N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2 |
| C.常温常压下,无色的NO能与空气中的O2直接化合生成红棕色的NO2 |
| D.在NO2与水的反应中,氧化剂与还原剂的质量之比为2:1 |
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:

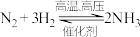 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。①下列情况
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
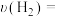
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
 。
。
您最近一年使用:0次
8 . 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为达到反应所需温度,需向原料气中掺入水蒸气,则K(主反应)_______ (填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______ 。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是_______ (填“i”、“ii”、“iii”或“iv”)。
②在恒温恒压条件下,下列叙述能说明主反应达到化学平衡状态的是_______
A.H2的生成速率等于C3H6的消耗速率
B.H2和C3H6的体积分数相等
C.混合气体的密度不再改变
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为ΔH=-283.0kJ·mol−1、ΔH=-285.8 kJ·mol−1。
①图中催化剂为_______ 。
②298K时,该工艺总反应的热化学方程式为_______ 。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______ 。

(1)丙烷脱氢制丙烯为强吸热过程。
①为达到反应所需温度,需向原料气中掺入水蒸气,则K(主反应)
②温度升高,副反应更容易发生的主要原因是
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是
②在恒温恒压条件下,下列叙述能说明主反应达到化学平衡状态的是
A.H2的生成速率等于C3H6的消耗速率
B.H2和C3H6的体积分数相等
C.混合气体的密度不再改变
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为ΔH=-283.0kJ·mol−1、ΔH=-285.8 kJ·mol−1。
①图中催化剂为
②298K时,该工艺总反应的热化学方程式为
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
名校
9 . 下列实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 比较Cl2和Br2的氧化性 | 取两段湿润的淀粉碘化钾试纸于两支试管中,分别通入少量Cl2和Br2,观察现象 |
| B | 鉴别75%乙醇溶液和无水乙醇 | 取等体积的溶液样品于两支试管中,分别加入一小块金属钠,观察现象 |
| C | 检验未知溶液中是否含有 | 取未知溶液样品于试管中,加入足量BaCl2溶液,有白色沉淀生成。再加入足量盐酸,观察沉淀是否溶解 |
| D | 证明FeCl3与KI的反应为可逆反应 | 向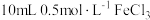 溶液中,加入 溶液中,加入 溶液,充分反应后,向溶液中加入几滴KSCN溶液,观察现象 溶液,充分反应后,向溶液中加入几滴KSCN溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-12更新
|
103次组卷
|
3卷引用:辽宁省凌源市高中2022-2023学年高二4月联考化学试题
名校
解题方法
10 . 我国科学家根据 在HZSM-5载体上的单层分散行为设计催化剂用于
在HZSM-5载体上的单层分散行为设计催化剂用于 选择性还原
选择性还原 。回答下列问题:
。回答下列问题:
已知:①
 kJ⋅mol
kJ⋅mol (
( )
)
②
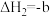 kJ⋅mol
kJ⋅mol (
( )
)
(1)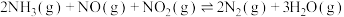

______ kJ⋅mol 。
。
(2)向恒容密闭容器中充入0.4 mol 和0.6 mol
和0.6 mol ,只发生反应①。下列叙述正确的是______(填标号)。
,只发生反应①。下列叙述正确的是______(填标号)。
(3)一定温度下,起始投料不变,单位时间内氮氧化物转化率、表面活泼氧量比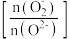 与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是
与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是______ (填具体催化剂名称)。 、2 mol
、2 mol  和4 mol
和4 mol  ,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。______ 。
②a→b段氮氧化物转化率变化的原因是____________ 。
③M点反应______ (填“达到”或“未达到”)平衡状态,判断依据是______ ,M→N段氮氧化物转化率变化的原因可能是____________ 。
(5)一定温度下,向体积为1 L的恒容密闭容器中充入1 mol 和2 mol
和2 mol ,在催化剂作用下发生反应:①
,在催化剂作用下发生反应:①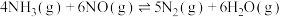 :②
:②
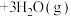 达到平衡时,NO转化率为70%,
达到平衡时,NO转化率为70%, 的选择性为50%[
的选择性为50%[ 的选择性
的选择性 ]该温度下,反应①的平衡常数
]该温度下,反应①的平衡常数
______ mol·L (列出计算式即可)。
(列出计算式即可)。
 在HZSM-5载体上的单层分散行为设计催化剂用于
在HZSM-5载体上的单层分散行为设计催化剂用于 选择性还原
选择性还原 。回答下列问题:
。回答下列问题:已知:①

 kJ⋅mol
kJ⋅mol (
( )
)②

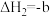 kJ⋅mol
kJ⋅mol (
( )
)(1)
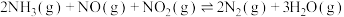

 。
。(2)向恒容密闭容器中充入0.4 mol
 和0.6 mol
和0.6 mol ,只发生反应①。下列叙述正确的是______(填标号)。
,只发生反应①。下列叙述正确的是______(填标号)。| A.恒温条件下,压强不随时间变化时反应达到平衡状态 |
B.平衡时温度不变,再充入1 mol  时平衡常数减小 时平衡常数减小 |
| C.反应达到平衡时放出的热量为0.1a kJ |
| D.加入高效催化剂,反应达到平衡时NO的转化率增大 |
(3)一定温度下,起始投料不变,单位时间内氮氧化物转化率、表面活泼氧量比
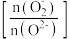 与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是
与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是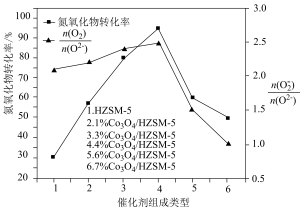
 、2 mol
、2 mol  和4 mol
和4 mol  ,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
②a→b段氮氧化物转化率变化的原因是
③M点反应
(5)一定温度下,向体积为1 L的恒容密闭容器中充入1 mol
 和2 mol
和2 mol ,在催化剂作用下发生反应:①
,在催化剂作用下发生反应:①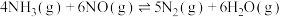 :②
:②
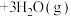 达到平衡时,NO转化率为70%,
达到平衡时,NO转化率为70%, 的选择性为50%[
的选择性为50%[ 的选择性
的选择性 ]该温度下,反应①的平衡常数
]该温度下,反应①的平衡常数
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-04-10更新
|
541次组卷
|
5卷引用:2024届辽宁省抚顺市六校协作体高三下学期第三次模拟化学试卷



