1 . 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,___________ mol/(L·s)。
(2)反应开始到10s,X的物质的量浓度减少了_________ mol/L。
(3)反应开始到10s,Y的转化率(已反应的原料的量/原料的总量×100%)_________ 。
(4)反应的化学方程式为_______________ 。
(5)10s后,下列说法能证明该反应已达到化学平衡状态的是______。

(2)反应开始到10s,X的物质的量浓度减少了
(3)反应开始到10s,Y的转化率(已反应的原料的量/原料的总量×100%)
(4)反应的化学方程式为
(5)10s后,下列说法能证明该反应已达到化学平衡状态的是______。
| A.单位时间内,消耗1molX,同时生成1molY |
| B.X、Y、Z的物质的量之比保持不变 |
| C.容器内体系的压强保持不变 |
| D.用X和Y表示的化学反应速率始终相等 |
您最近一年使用:0次
2 . 氨是一种重要的化工原料和储氢材料。回答下列问题:
(1)已知反应:
① □
□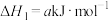
② □
□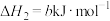
③ □
□
则反应 的
的
_______  。
。
(2)在恒容密闭容器中,发生反应 ,下列说法可以证明反应已达到平衡状态的是
,下列说法可以证明反应已达到平衡状态的是_______ (填字母)。
A.单位时间内生成 的同时生成
的同时生成
B.1个 键断裂的同时,有6个
键断裂的同时,有6个 键形成
键形成
C.1个 键断裂的同时,有3个
键断裂的同时,有3个 键形成
键形成
D.混合气体的密度不再改变的状态
E.混合气体的压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(3)已知 和
和 以物质的量之比为
以物质的量之比为 在不同温度和压强下发生反应:
在不同温度和压强下发生反应: ,测得平衡体系中
,测得平衡体系中 的物质的量分数如图所示。
的物质的量分数如图所示。
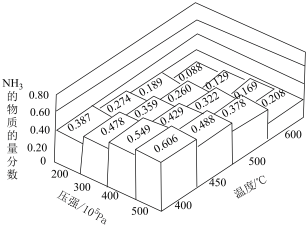
图中所示的平衡体系中 的物质的量分数为0.488和0.429时,该反应的平衡常数分别为
的物质的量分数为0.488和0.429时,该反应的平衡常数分别为 、
、 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)在一定条件下,向某反应容器中投入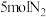 和
和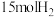 ,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
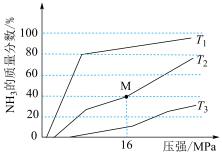
①温度 、
、 、
、 中,最大的是
中,最大的是_______ 。
② 点
点 的转化率为
的转化率为_______ 。
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入 和
和 (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
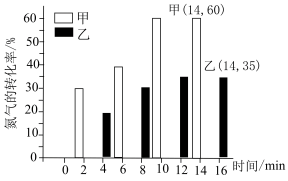
①相对于乙,甲改变的条件是_______ (填字母)。
A.增大压强 B.升高温度 C.加入催化剂 D.分离氨
②在甲条件下,平衡时体积为 ,则该反应的平衡常数
,则该反应的平衡常数 为
为_______ (结果保留三位有效数字)。
(1)已知反应:
①
 □
□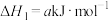
②
 □
□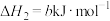
③
 □
□
则反应
 的
的
 。
。(2)在恒容密闭容器中,发生反应
 ,下列说法可以证明反应已达到平衡状态的是
,下列说法可以证明反应已达到平衡状态的是A.单位时间内生成
 的同时生成
的同时生成
B.1个
 键断裂的同时,有6个
键断裂的同时,有6个 键形成
键形成C.1个
 键断裂的同时,有3个
键断裂的同时,有3个 键形成
键形成D.混合气体的密度不再改变的状态
E.混合气体的压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(3)已知
 和
和 以物质的量之比为
以物质的量之比为 在不同温度和压强下发生反应:
在不同温度和压强下发生反应: ,测得平衡体系中
,测得平衡体系中 的物质的量分数如图所示。
的物质的量分数如图所示。
图中所示的平衡体系中
 的物质的量分数为0.488和0.429时,该反应的平衡常数分别为
的物质的量分数为0.488和0.429时,该反应的平衡常数分别为 、
、 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)在一定条件下,向某反应容器中投入
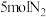 和
和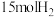 ,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:
①温度
 、
、 、
、 中,最大的是
中,最大的是②
 点
点 的转化率为
的转化率为(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入
 和
和 (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙容器中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
①相对于乙,甲改变的条件是
A.增大压强 B.升高温度 C.加入催化剂 D.分离氨
②在甲条件下,平衡时体积为
 ,则该反应的平衡常数
,则该反应的平衡常数 为
为
您最近一年使用:0次
名校
3 . 甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应i.
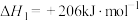 ;
;
反应ii.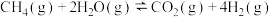
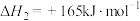 。
。
回答下列问题:
(1)反应iii. 的
的
________  ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有________ ,下列说法可以证明该反应已达到平衡状态的是________ (填字母)。
a. b.容器内气体压强不再改变
b.容器内气体压强不再改变
c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
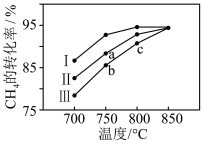
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是”)化学平衡状态。
(3)某科研小组研究了反应ii的动力学,获得其速率方程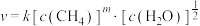 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得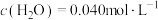 ,则此时的反应速率v=
,则此时的反应速率v=___________  (已知
(已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,
 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为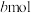 ,则反应i的平衡常数
,则反应i的平衡常数
___________ [写出含有a、b的计算式;对于反应 ,
,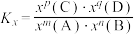 ,x为物质的量分数]。
,x为物质的量分数]。
反应i.

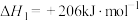 ;
;反应ii.
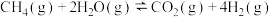
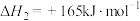 。
。回答下列问题:
(1)反应iii.
 的
的
 ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有a.
 b.容器内气体压强不再改变
b.容器内气体压强不再改变c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为
 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ii的动力学,获得其速率方程
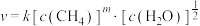 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:| 实验序号 |  |  |  |
| 1 | 0.100 | 0.100 |  |
| 2 | 0.100 | 0.200 |  |
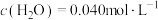 ,则此时的反应速率v=
,则此时的反应速率v= (已知
(已知 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,

 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为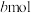 ,则反应i的平衡常数
,则反应i的平衡常数
 ,
,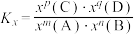 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
解题方法
4 . T℃时,在体积为2L的密闭容器内,与同一个化学反应有关的A、B、C、D四种物质(D为固体,其余均为气体)的物质的量随反应时间变化的曲线如图所示,回答下列问题。
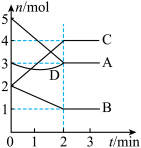
(1)该反应的化学方程式为_______ 。
(2)物质D在反应中的作用是______ 。
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是______ (填字母);在0~2min内用O2表示的反应速率v(O2)=______ 。
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是_______ 。
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。
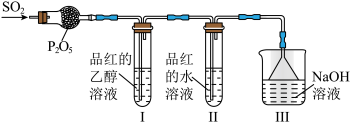
查阅资料:SO2通入水中存在如下反应:SO2+xH2O SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。
通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.______ ;iii.______ 。
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
该实验说明,两种粒子中,______ 使品红水溶液褪色程度更大。
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明______ ;取实验2所得溶液直接加热,则慢慢恢复浅红色,说明NaHSO3与品红生成的物质不稳定。

(1)该反应的化学方程式为
(2)物质D在反应中的作用是
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。

查阅资料:SO2通入水中存在如下反应:SO2+xH2O
 SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
| 实验序号 | 实验1 | 实验2 |
| 实验操作 |  2mL0.20mol•L-1Na2SO3溶液 | 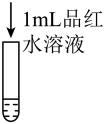 2mL0.20mol•L-1NaHSO3溶液 |
| 实验现象 | 迅速褪色 | 褪色较慢 |
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明
您最近一年使用:0次
2023-04-28更新
|
407次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高一下学期4月期中考试化学试题
22-23高二上·全国·课后作业
名校
解题方法
5 . 下列说法中,可以证明反应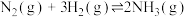 已达到平衡状态的是
已达到平衡状态的是
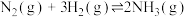 已达到平衡状态的是
已达到平衡状态的是| A.1个N≡N键断裂的同时,有3个H-H键形成 |
| B.1个N≡N键断裂的同时,有3个H-H键断裂 |
| C.3个H-H键形成的同时,有6个N-H键断裂 |
| D.1个N≡N键断裂的同时,有6个N-H键形成 |
您最近一年使用:0次
2022-10-18更新
|
622次组卷
|
5卷引用:黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期期中考试化学试题
名校
6 . 在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率,下列关于化学反应速率和程度说法正确的是
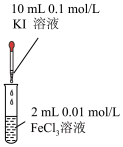 |  |  |  |
① | ② | ③ | ④ |
A.取少量图①充分反应后的溶液于试管中,若滴加KSCN溶液后溶液呈红色可以证明可逆反应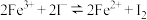 存在反应进行的限度 存在反应进行的限度 |
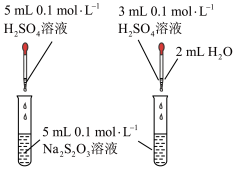
B.若图②是将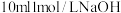 溶液一次性且快速加入到 溶液一次性且快速加入到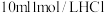 ,结束反应10s,则HCl的化学反应速率为 ,结束反应10s,则HCl的化学反应速率为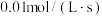 |
C.图③可以探究 浓度对化学反应速率的影响:左试管的速率大于右试管的速率 浓度对化学反应速率的影响:左试管的速率大于右试管的速率 |
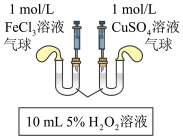
D.图④比较 、 、 对反应 对反应 分解制氧气的化学反应速率催化效果 分解制氧气的化学反应速率催化效果 |
您最近一年使用:0次
2022-07-03更新
|
278次组卷
|
4卷引用:江西省九江市德安县第一中学2022-2023学年高一下学期5月期中考试化学试题
7 . “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是
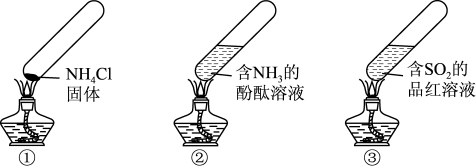

| A.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验原理相似 |
| B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小 |
| C.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性 |
| D.三个“封管实验”中所涉及到的化学反应均为可逆反应 |
您最近一年使用:0次
2022-04-21更新
|
386次组卷
|
3卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题
真题
名校
8 . 关于反应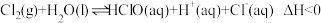 ,达到平衡后,下列说法
,达到平衡后,下列说法不正确 的是
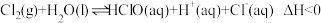 ,达到平衡后,下列说法
,达到平衡后,下列说法A.升高温度,氯水中的 减小 减小 |
B.氯水中加入少量醋酸钠固体,上述平衡正向移动, 增大 增大 |
C.取氯水稀释,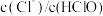 增大 增大 |
D.取两份氯水,分别滴加 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度 |
您最近一年使用:0次
2022-06-14更新
|
7608次组卷
|
28卷引用:安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题
安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题(已下线)【2022】【高二上】【期中考】【高中化学】592022年6月浙江省普通高校招生选考化学试题(已下线)2022年浙江省6月高考真题变式题11-20(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷11 化学反应速率与化学平衡归因分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)模块综合检测卷2(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第三章 水溶液中的离子反应与平衡 第一节 电离平衡浙江省余姚中学2023-2024学年高二上学期第一次月考化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西省西安市2023-2024学年高二上学期期末化学测试卷B广东省江门市第一中学2023-2024学年高二上学期第二次段考化学(选考)试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题海南省海桂中学2023-2024学年高二上学期12月教学检测(三)化学试题2024届海南省海南中学高三下学期第一次模拟化学试题
名校
解题方法
9 . 下列说法可以证明反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是| A.消耗1molN2的同时,生成2molNH3 |
| B.N2、H2、NH3的反应速率比为1:3:2的状态 |
| C.1molN≡N键断裂的同时,有6molN-H键断裂 |
| D.N2和H2浓度相等的时候 |
您最近一年使用:0次
2022-05-20更新
|
324次组卷
|
4卷引用:广东省广州市第九十七中学2021-2022学年高一下学期期中考试化学试题
名校
10 . 蕴藏在海底的大量“可燃冰”(甲烷的水合物)是一种清洁燃料,其开发利用是解决能源危机的重要课题。在一定条件下 与
与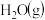 可发生反应:
可发生反应:

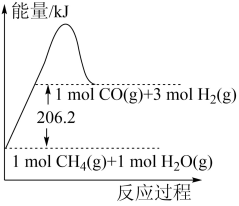
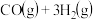 ,该反应的能量变化如下图所示。
,该反应的能量变化如下图所示。
请回答下列问题:
(1)请用电子式表示CH4的形成过程_______ 。
(2)在一定条件下,由一定量的 和
和 反应生成了
反应生成了 和6molH2(g)时所吸收的热量为
和6molH2(g)时所吸收的热量为_______ kJ。
(3)下列措施中可以加快该反应的化学反应速率的是_______  填字母
填字母 。
。
A.恒温恒容条件下,向其中充入
B.恒温恒压条件下,向其中充入
C.恒温恒容条件下,向其中充入
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2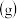
(4)T℃下,在容积为2L的恒容密闭容器中通入 和
和 发生该反应。
发生该反应。
①下列说法中能证明该反应已达到化学平衡状态的是_______  填字母
填字母 。
。
A.单位时间内消耗
 的同时生成了
的同时生成了
B.一个 键断裂的同时有三个
键断裂的同时有三个 键断裂
键断裂
C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.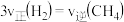
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时 的转化率为
的转化率为_______ ,CO的体积分数为_______ %(计算结果保留一位小数 )。
 与
与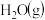 可发生反应:
可发生反应:

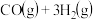 ,该反应的能量变化如下图所示。
,该反应的能量变化如下图所示。
请回答下列问题:
(1)请用电子式表示CH4的形成过程
(2)在一定条件下,由一定量的
 和
和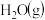 反应生成了
反应生成了 和6molH2(g)时所吸收的热量为
和6molH2(g)时所吸收的热量为(3)下列措施中可以加快该反应的化学反应速率的是
 填字母
填字母 。
。A.恒温恒容条件下,向其中充入

B.恒温恒压条件下,向其中充入

C.恒温恒容条件下,向其中充入
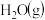
D.其他条件不变,降低温度
E.其他条件不变,减小容器的体积
F.其他条件不变,及时分离出生成的H2
(4)T℃下,在容积为2L的恒容密闭容器中通入
 和
和 发生该反应。
发生该反应。①下列说法中能证明该反应已达到化学平衡状态的是
 填字母
填字母 。
。A.单位时间内消耗

 的同时生成了
的同时生成了
B.一个
 键断裂的同时有三个
键断裂的同时有三个 键断裂
键断裂C.密闭容器中混合气体的密度不再变化
D.混合气体的平均相对分子质量不再变化
E.
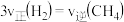
F.密闭容器内总压强不再变化
②若该反应达到化学平衡状态时,容器内气体的压强变为起始压强的1.6倍,则达平衡时
 的转化率为
的转化率为
您最近一年使用:0次
2022-04-18更新
|
256次组卷
|
2卷引用:湖北省新高考联考协作体2021-2022学年高一下学期期中考试化学试题



