名校
1 . 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是________ ,该反应的平衡常数表达式为K=________ 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率 与时间t的关系如图。
与时间t的关系如图。
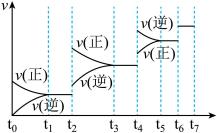
若t2时改变的条件为加热,则此反应的反应热ΔH______ 0(填“>”、“<”或“=”);降低温度,其平衡常数值_______ (填“增大”、“减小”或“不变”);
(3)t4时引起平衡移动的条件可能是_______ ;图中表示平衡混合物中CO的含量最高的时间段是______ 。
(4)若该反应的平衡常数为 K=729,则在同温度下1L固定密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是_______ (提示:272 = 729);若平衡后再向此容器中加入3molN2,N2的转化率将______ (填“增大”、“减小”或“不变”)。
 Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。(1)该反应的氧化剂是
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率
 与时间t的关系如图。
与时间t的关系如图。
若t2时改变的条件为加热,则此反应的反应热ΔH
(3)t4时引起平衡移动的条件可能是
(4)若该反应的平衡常数为 K=729,则在同温度下1L固定密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
您最近一年使用:0次
名校
2 . 工业上可利用 或
或 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(
来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数( 、
、 、
、 )如下表所示:
)如下表所示:
请回答下列问题:
(1)根据反应①与②可推导出
___________ (用 、
、 表示);
表示);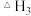
___________ 0(用“>”或“<”表示);
(2)根据反应①与②可推导出
___________ (用 、
、 表示);
表示);
(3)恒温恒容下,对反应①,下列各项可作为该反应达到平衡状态的标志的是___________
(4)恒容、500℃下,测得反应②在某时刻时, 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时
,则此时
___________  (填“>”“=”或“<”),达平衡时
(填“>”“=”或“<”),达平衡时 的浓度为
的浓度为___________ 
(5)下列图像符合反应③的是___________
 或
或 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(
来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数( 、
、 、
、 )如下表所示:
)如下表所示:| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
① |  | 2.5 | 0.34 | 0.15 |
② |  | 1.0 | 1.70 | 2.52 |
③ |  | |||
(1)根据反应①与②可推导出

 、
、 表示);
表示);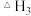
(2)根据反应①与②可推导出

 、
、 表示);
表示);(3)恒温恒容下,对反应①,下列各项可作为该反应达到平衡状态的标志的是___________
| A.压强不再变化 | B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 | D. |
 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时
,则此时
 (填“>”“=”或“<”),达平衡时
(填“>”“=”或“<”),达平衡时 的浓度为
的浓度为
(5)下列图像符合反应③的是___________
A. | B. |
C. | D. |
您最近一年使用:0次
2023-10-20更新
|
292次组卷
|
4卷引用:重庆市重点中学2023-2024学年高二上学期10月联考化学试题
名校
3 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图:

(1)电解饱和食盐水的化学方程式为_______ 。结合电极反应式说明生成溶液a的原理_______ 。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是_______ (填字母序号)。
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.升高阳极区液面上方的气压
(3)二氧化氯(ClO2)为一种黄绿色气体。阳极产生副产物ClO2的电极反应式:_______ 。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:_____ 。

(1)电解饱和食盐水的化学方程式为
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.升高阳极区液面上方的气压
(3)二氧化氯(ClO2)为一种黄绿色气体。阳极产生副产物ClO2的电极反应式:
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:
您最近一年使用:0次
名校
4 . 消除氮氧化物的污染是当前科学研究的热点,根据所学知识回答下列问题:
(1)已知①
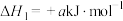 ;②
;② 的燃烧热为
的燃烧热为
 ,则反应
,则反应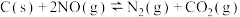 的
的
_________  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2)已知 和
和 可以相互转化,反应
可以相互转化,反应

 。在温度一定时,平衡体系中
。在温度一定时,平衡体系中 的体积分数
的体积分数 随压强的变化情况如图所示。
随压强的变化情况如图所示。

①A、C两点的正反应速率的关系为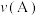
_________ (填“>”、“<”或“=”)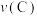 。
。
②A、B、C、D、E各状态, 的是状态
的是状态_________ 。
③E→A所需时间为x,DC所需时间为y,则x_________ (填“>”、<"或“=”)y。
(3)在一定条件下, 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下, 时,发生反应,平衡混合气中
时,发生反应,平衡混合气中 的物质的量分数随温度和压强变化的关系如图所示。
的物质的量分数随温度和压强变化的关系如图所示。
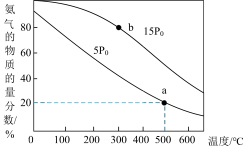
①该反应的平衡常数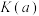
_________ (填“<”、“=”或“>”)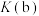 。
。
②500℃、压强为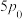 时,
时, 的转化率为
的转化率为_________ %(保留三位有效数字),
_________ 。[ 为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(1)已知①

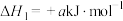 ;②
;② 的燃烧热为
的燃烧热为
 ,则反应
,则反应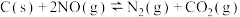 的
的
 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)已知
 和
和 可以相互转化,反应
可以相互转化,反应

 。在温度一定时,平衡体系中
。在温度一定时,平衡体系中 的体积分数
的体积分数 随压强的变化情况如图所示。
随压强的变化情况如图所示。
①A、C两点的正反应速率的关系为
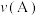
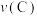 。
。②A、B、C、D、E各状态,
 的是状态
的是状态③E→A所需时间为x,DC所需时间为y,则x
(3)在一定条件下,
 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下, 时,发生反应,平衡混合气中
时,发生反应,平衡混合气中 的物质的量分数随温度和压强变化的关系如图所示。
的物质的量分数随温度和压强变化的关系如图所示。
①该反应的平衡常数
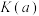
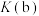 。
。②500℃、压强为
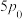 时,
时, 的转化率为
的转化率为
 为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
您最近一年使用:0次
2022-12-16更新
|
449次组卷
|
6卷引用:重庆市2022-2023学年高二上学期12月调研考试化学试题
5 . 在密闭容器中,使 2 mol N2和 6 mol H2混合发生下列反应:N2 (g)+3H2 (g) 2NH3(g) Δ H<0。
2NH3(g) Δ H<0。
(1)当反应达到平衡时,N2和H2的浓度比是_______ ;N2和H2的转化率比是_______ 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______ ;密度_______ 。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增加一倍,平衡将_______ 。(填“正移”“逆移”或“不移动”,下同)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将_______ 。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将_______ (填“正移”“逆移”或“不移动”),达到新平衡后,容器内温度_______ (填“大于”“小于”或“等于”)原来的2倍。
 2NH3(g) Δ H<0。
2NH3(g) Δ H<0。(1)当反应达到平衡时,N2和H2的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增加一倍,平衡将
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将
您最近一年使用:0次
6 . 以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=_______ 。平衡时H2的转化率为_______ 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有_______。
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①写出化学平衡常数K的表达式_______ 。
②试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”)。
③400 ℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为_______ 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和1 mol时,则该反应的v(N2)正_______ v(N2)逆(填“>”、“<”或“=”)。
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则平衡时c(N2)=(2)平衡后,若要提高H2的转化率,可以采取的措施有_______。
| A.加入催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①写出化学平衡常数K的表达式
②试比较K1、K2的大小,K1
③400 ℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近一年使用:0次
名校
7 . I.甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: 2 CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
(2)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
① 10~30 min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
② CH3OH(g)的平衡转化率为_______ 。
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)。
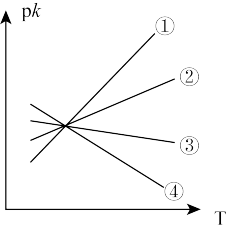
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线_______ 。
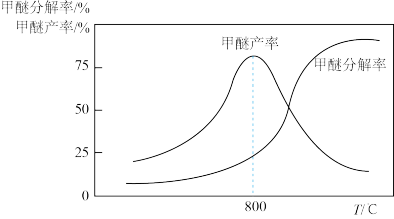
(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为_______ 。
II.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
(5)当压强从2×105增加到时5×105,平衡_______ 移动。(填“正向”、“逆向”或“不”)
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =_______ 。
 CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 | B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
② CH3OH(g)的平衡转化率为
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.64 | 0.68 | 0.68 |
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线

(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为

II.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol/L) | 0.08 | 0.20 | 0.44 |
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =
您最近一年使用:0次
名校
8 . I.现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2⑩Al2O3,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
II.工业合成氨N2(g)+3H2(g) 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
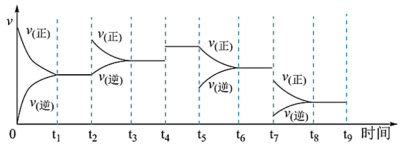
(4)其中 t4时刻所对应的实验条件改变是_____ ,t5时刻所对应的实验条件改变是_____ ,平衡常数最大的时间段是_____ 。
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
(6)实际生产中一般采用的反应条件为400~500℃,原因是_______ 。
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
II.工业合成氨N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g) ∆H=-92.2kJ∙mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
(4)其中 t4时刻所对应的实验条件改变是
(5)为了提高平衡混合物中氨的含量,根据化学平衡移动原理,仅从理论上分析合成氨适宜的条件是_______(填字母)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
您最近一年使用:0次
名校
9 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为___________ 热反应,且m+n___________ p(填“>”“=”“<”)。
(2)减压时,A的质量分数___________ 。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时B、C的浓度之比将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色___________ (填“变深”“变浅”或“不变”)。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色
您最近一年使用:0次
2022-08-16更新
|
267次组卷
|
2卷引用:重庆市天星桥中学2021-2022学年高二上学期第二次月考化学试题
解题方法
10 . 氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使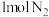 和
和 混合发生下列反应:
混合发生下列反应:
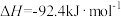 。
。
①反应进行一段时间后, 和
和 的转化率之比
的转化率之比______ 1(填“>”“<”或“=”)。
②当达到平衡时,充入氩气,并保持体积不变,平衡将______ (填“正向”“逆向”或“不”)移动。
③恒温下,压缩容器体积,混合气体的平均相对分子质量______ ,密度______ (填“变大”“变小”或“不变”)。
(2)水煤气在一定条件下可合成甲醇: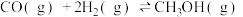
 。将1mol CO和
。将1mol CO和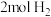 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
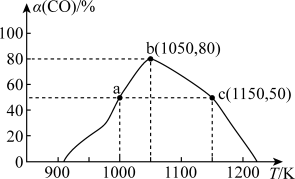
①试求温度为1000K条件下,反应开始至2min时,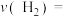
______ 。
②由图可知,从反应开始到b点之前,CO的转化率随温度升高而增大,原因是____________________ 。
③已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为______ (不用写单位, 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
(1)在密闭容器中,使
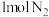 和
和 混合发生下列反应:
混合发生下列反应:
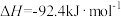 。
。①反应进行一段时间后,
 和
和 的转化率之比
的转化率之比②当达到平衡时,充入氩气,并保持体积不变,平衡将
③恒温下,压缩容器体积,混合气体的平均相对分子质量
(2)水煤气在一定条件下可合成甲醇:
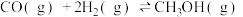
 。将1mol CO和
。将1mol CO和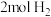 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,
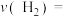
②由图可知,从反应开始到b点之前,CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近一年使用:0次



