名校
解题方法
1 . I.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________ 。
(2)在实际生产中,选定的温度为400~500℃,原因是________ 。
(3)在实际生产中,采用的压强为常压,原因是________ 。
(4)在实际生产中,通入过量的空气,原因是________ 。
(5)尾气中SO2必须回收,原因是________ 。
II.Bodenstein研究了反应:2HI(g) H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
(6)根据上述实验结果,该反应的平衡常数K的计算式为________ 。
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为_______ (用含K和k正的代数式表示)。
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

(8)A点时,CH3COOCH3(g)的平衡分压为________ ,CH3CH2OH(g)的体积分数为________ %(保留一位小数)。
(9)此温度下,该反应的化学平衡常数Kp=______ MPa-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是
(2)在实际生产中,选定的温度为400~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
II.Bodenstein研究了反应:2HI(g)
 H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(6)根据上述实验结果,该反应的平衡常数K的计算式为
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(8)A点时,CH3COOCH3(g)的平衡分压为
(9)此温度下,该反应的化学平衡常数Kp=
您最近一年使用:0次
名校
2 . 回答下列问题:
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=________ 。
(2)该反应为________ 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________ 。
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为_______ ℃。
Ⅱ.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0,其平衡常数K=
Fe(s)+CO2(g) △H>0,其平衡常数K=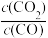 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。
(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值_______ (填“增大”、“减小”或“不变”):平衡常数K值________ (填“增大”、“减小”或“不变”)。
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态______ (填“是”或“否”),此时v正______ v逆(填“>”或“=”或“<”)。
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
Ⅱ.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)
 Fe(s)+CO2(g) △H>0,其平衡常数K=
Fe(s)+CO2(g) △H>0,其平衡常数K=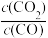 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态
您最近一年使用:0次
3 . 在一定温度下,向一容积为2 L的恒容密闭容器中充入4 mol SO2和2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ∆H =-196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
2SO3(g) ∆H =-196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是___________ (填字母);
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)从反应开始到平衡的这段时间O2的转化率为___________ ,该温度下,该反应的平衡常数为___________ 。
(3)如图表示在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是___________ 。
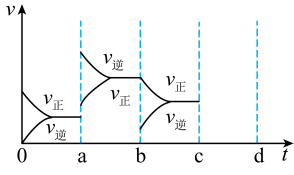
(4)在相同温度下,若起始时加入6mol SO2和3 mol O2,反应进行一段时间后,测得O2的浓度为 1.0mol•L-1,则此时该反应是否达到平衡状态___________ (填“是”与“否”),此时 V(正) ___________ V(逆)(填“大于”“小于”或“等于”)
 2SO3(g) ∆H =-196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:
2SO3(g) ∆H =-196 kJ/mol。经2 min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.8倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)从反应开始到平衡的这段时间O2的转化率为
(3)如图表示在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是

(4)在相同温度下,若起始时加入6mol SO2和3 mol O2,反应进行一段时间后,测得O2的浓度为 1.0mol•L-1,则此时该反应是否达到平衡状态
您最近一年使用:0次
4 . 回答下列问题。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
回答下列问题:
①过氧化氢与氢碘酸反应的化学方程式为___________ 。
②该反应的速率方程可表示为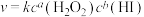 ,对比表中数据可知a=
,对比表中数据可知a=___________ ,b=___________ 。
③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是___________ 。
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
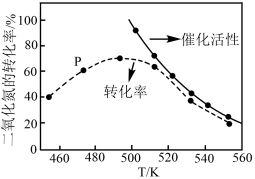
①温度为470K时,图中P点___________ (填“处于”或“不处于”)平衡状态。判断理由是___________ 。490K之后,二氧化氮的转化率随温度升高而减小的原因可能是___________ 。
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:___________ 。
(1)某学习小组同学研究过氧化氢溶液与氢碘酸反应,查到一组室温下的实验数据,如下表所示:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(H2O2) mol/L | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
| c(HI) mol/L | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从混合至溶液出现棕黄色的时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
①过氧化氢与氢碘酸反应的化学方程式为
②该反应的速率方程可表示为
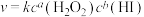 ,对比表中数据可知a=
,对比表中数据可知a=③该小组同学将实验④的温度升高,发现加热到一定温度下,溶液出现棕黄色所需时间变长,可能的原因是
(2)工业上用CH4催化还原NO2可以消除氮氧化物的污染,反应原理为:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ·mol-1。一定比例的甲烷和二氧化氮的混合气在装有催化剂的反应器中反应一段时间。体系中二氧化氮的转化率和催化剂的催化活性与温度的关系如图所示。
①温度为470K时,图中P点
A.催化剂的活性降低 B.平衡常数变大 C.反应活化能增大
②为提高反应中的二氧化氮的转化率,有人提出可以采取在恒压条件下充入稀有气体,解释其原因:
您最近一年使用:0次
2023-10-10更新
|
169次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2023-2024学年高二上学期10月月考化学试题
名校
5 . 丙酮蒸气热裂解可生产乙烯酮,反应为 (g)
(g)
 +
+ 
 ,现对该热裂解反应进行研究,回答下列问题:
,现对该热裂解反应进行研究,回答下列问题:
(1)根据表格中的键能数据,计算
___________  ;
;
(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是___________。
(3)丙酮的平衡转化率随温度、压强变化如图所示:

①图中X表示的物理量是______ ;
②A、C两点化学平衡常数
______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是______ 。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间t min,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)______ kPa/min;
②该条件平衡时丙酮分解率为a,则
______ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(5)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图。

①工业上选择催化剂___________ (填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,丙酮转化率降低的原因可能是___________ (写一条即可)。
 (g)
(g)
 +
+ 
 ,现对该热裂解反应进行研究,回答下列问题:
,现对该热裂解反应进行研究,回答下列问题:| 化学键 | C—H | C—C |  |
键能 | 412 | 348 | 612 |

 ;
;(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是___________。
A. 消耗速率与 消耗速率与 生成速率相等 生成速率相等 |
| B.容器内密度不再变化 |
| C.反应的平衡常数不再变化 |
| D.混合气体的平均相对分子质量不再变化 |

①图中X表示的物理量是
②A、C两点化学平衡常数

 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间t min,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)
②该条件平衡时丙酮分解率为a,则

 总压
总压 物质的量分数)。
物质的量分数)。(5)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图。

①工业上选择催化剂
②在催化剂甲作用下,温度高于210℃时,丙酮转化率降低的原因可能是
您最近一年使用:0次
2023-05-04更新
|
318次组卷
|
4卷引用:黑龙江省鹤岗市第三中学2023-2024学年高二上学期10月月考化学试题
黑龙江省鹤岗市第三中学2023-2024学年高二上学期10月月考化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题湖北省宜昌市部分省级示范高中校级联合体2022-2023学年高二下学期期中考试化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
6 . 完成下列问题
(1)密闭容器中发生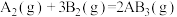 反应,若
反应,若 ,则正反应一定是
,则正反应一定是__________ 反应(填“放热”或“吸热”)。在其他条件不变的情况下,只改变起始 的物质的量,在a、b、c三点达到平衡时,
的物质的量,在a、b、c三点达到平衡时,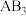 的物质的量由大到小的顺序为
的物质的量由大到小的顺序为_____ 。

(2)已知反应
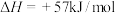 ,在温度为
,在温度为 、
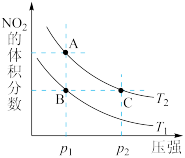
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
的体积分数随压强变化曲线如图所示。A、C两点气体的颜色_____ 点深。(填“A”或“C”)A、B两点的平均相对分子质量:A_____ B(填“>”“=”或“<”)。
(3)在容积可变的密闭容器中发生反应 ,
, 随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在
随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在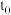 时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为__________ L实现。
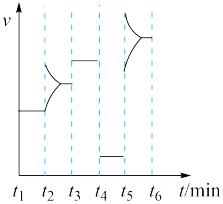
(4)某密闭容器中发生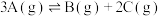 ,
,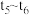 阶段,容器内A的物质的量减少了
阶段,容器内A的物质的量减少了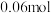 ,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式__________ 。
(1)密闭容器中发生
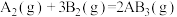 反应,若
反应,若 ,则正反应一定是
,则正反应一定是 的物质的量,在a、b、c三点达到平衡时,
的物质的量,在a、b、c三点达到平衡时,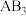 的物质的量由大到小的顺序为
的物质的量由大到小的顺序为
(2)已知反应

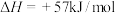 ,在温度为
,在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
的体积分数随压强变化曲线如图所示。A、C两点气体的颜色
(3)在容积可变的密闭容器中发生反应
 ,
, 随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在
随反应时间的变化如图中曲线Ⅰ所示,此时平衡时体积为1L,若在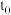 时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
时刻改变一个条件,使曲线Ⅰ变为曲线Ⅲ时,可通过将容器的体积变为
(4)某密闭容器中发生
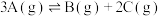 ,
,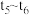 阶段,容器内A的物质的量减少了
阶段,容器内A的物质的量减少了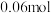 ,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
,而此过程中容器与外界的热交换总量为akJ,书写反应的热化学方程式
您最近一年使用:0次
7 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
两步基元反应如下:
①CO2(g)+H2(g) H2O(g)+CO(g) △H1=+41kJ•mol-1
H2O(g)+CO(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1
(1)若反应①为慢反应,如图的示意图中能体现上述反应能量变化的是____ (填标号)。
(2)已知下列各组热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-25kJ•mol-1 K1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ•mol-1K2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ•mol-1K3
请写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式:____ ,写出该反应的平衡常数表达式____ 。
(3)表格列出了在不同温度和压强下,CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应达到平衡时H2的转化率。
CH3OH(g)+H2O(g)反应达到平衡时H2的转化率。
实际生产中,采用的压强为常压,原因是____ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。两步基元反应如下:
①CO2(g)+H2(g)
 H2O(g)+CO(g) △H1=+41kJ•mol-1
H2O(g)+CO(g) △H1=+41kJ•mol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1(1)若反应①为慢反应,如图的示意图中能体现上述反应能量变化的是
A. | B. |
C. | D. |
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-25kJ•mol-1 K1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ•mol-1K2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ•mol-1K3
请写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式:
(3)表格列出了在不同温度和压强下,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应达到平衡时H2的转化率。
CH3OH(g)+H2O(g)反应达到平衡时H2的转化率。| 温度/℃ | 平衡时H2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | 0.1MPa |
| 950 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 1150 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
实际生产中,采用的压强为常压,原因是
您最近一年使用:0次
8 . 已知可逆反应:M(g)+N(g) ⇌ P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol·L-1,c(N)=2.4mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为_______ 。
(2)该温度下,反应的K值为_______ 。
(3)若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”)。
(4)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2mol·L-1,a=_______ 。
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol·L-1,c(N)=2.4mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为
(2)该温度下,反应的K值为
(3)若反应温度升高,M的转化率
(4)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2mol·L-1,a=
您最近一年使用:0次
9 . 碘化氢是一种强还原剂,是卤化氢中化学性质最不稳定的,其分解可获得H2和I2: 2HI(g) H2(g)+I2(g)。请回答:
H2(g)+I2(g)。请回答:
(1)一定温度下,在恒容密闭容器中充入一定量HI发生反应,下列情况表明反应达到平衡状态的是_______ (填标号)。
A.密度不随时间的变化而变化
B.HI与H2的浓度之比为2:1
C.H2的体积分数不随时间的变化而变化
D. 体系的颜色保持不变
E.平均摩尔质量不随时间的变化而变化
F. 体系的温度保持不变
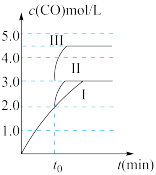
(2)在2L恒容密闭容器中充入2molHI(g),在一定条件下发生反应,测得I2(g)的物质的量与温度、时间的关系如图。

T1℃下,0~10min内HI的平均反应速率为_______ ,此温度下的化学平衡常数K=_______ HI的平衡转化率为_______ 。
(3)保持容器体积不变,向其中加amolH2,则正反应速率_______ (填“增大”或“减小”或“不变”,下同),逆反应速率_______ ,平衡_______ (填“正向移动”或“逆向移动”或“不移动”)。
 H2(g)+I2(g)。请回答:
H2(g)+I2(g)。请回答:(1)一定温度下,在恒容密闭容器中充入一定量HI发生反应,下列情况表明反应达到平衡状态的是
A.密度不随时间的变化而变化
B.HI与H2的浓度之比为2:1
C.H2的体积分数不随时间的变化而变化
D. 体系的颜色保持不变
E.平均摩尔质量不随时间的变化而变化
F. 体系的温度保持不变
(2)在2L恒容密闭容器中充入2molHI(g),在一定条件下发生反应,测得I2(g)的物质的量与温度、时间的关系如图。

T1℃下,0~10min内HI的平均反应速率为
(3)保持容器体积不变,向其中加amolH2,则正反应速率
您最近一年使用:0次
名校
10 . 室温下,初始浓度为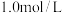 的
的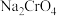 溶液中
溶液中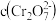 随
随 的变化如图所示,回答下列问题:
的变化如图所示,回答下列问题:

(1)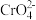 和
和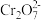 在溶液中相互转化的离子方程式
在溶液中相互转化的离子方程式_______ 。
(2)由图可知,随着溶液酸性增强,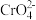 的平衡转化率
的平衡转化率_______ (填“增大”、“减小”或“不变”)。根据 点数据,计算出该转化反应的平衡常数为
点数据,计算出该转化反应的平衡常数为_______ 。
(3)升高温度,溶液中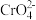 的平衡转化率减小,则该反应的∆H
的平衡转化率减小,则该反应的∆H_______ 0(填“大于”、“小于”或“等于”)。
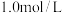 的
的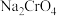 溶液中
溶液中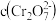 随
随 的变化如图所示,回答下列问题:
的变化如图所示,回答下列问题:
(1)
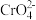 和
和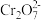 在溶液中相互转化的离子方程式
在溶液中相互转化的离子方程式(2)由图可知,随着溶液酸性增强,
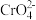 的平衡转化率
的平衡转化率 点数据,计算出该转化反应的平衡常数为
点数据,计算出该转化反应的平衡常数为(3)升高温度,溶液中
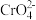 的平衡转化率减小,则该反应的∆H
的平衡转化率减小,则该反应的∆H
您最近一年使用:0次
2022-09-21更新
|
83次组卷
|
2卷引用:黑龙江省饶河县高级中学2022-2023学年高二上学期第一次月考化学试题



