名校
1 . 环戊二烯(C5H6)是一种重要的有机合成原料,常用于有机合成及树脂交联等。
Ⅰ.用其制备环戊烯:
方法一:___________ kJ·mol-1。
①平衡时HI的体积分数为___________ %。
②用平衡分压代替平衡浓度计算压强平衡常数KP=___________ (KPa)-1(要求用最简整数比,含P0的代数式表示)。
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡___________ 移动(填“正向”“逆向”或“不”)。___________ T2(填“>"“<”或“=”)。
(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是___________ 。
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.
d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁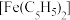 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为___________ 。二茂铁的晶胞结构如图所示(未画出微粒),密度为ρg/cm-3,设阿伏加德罗常数的值为NA,则一个晶胞中含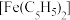 的数目为
的数目为___________ 。
Ⅰ.用其制备环戊烯:
方法一:
反应①: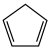 (g)+H2(g)
(g)+H2(g)
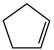 (g) ΔH1=-100.3 kJ·mol-1
(g) ΔH1=-100.3 kJ·mol-1
反应②: (g)+H2(g)
(g)+H2(g)
 (g) ΔH2=-109.4 kJ·mol-1
(g) ΔH2=-109.4 kJ·mol-1
反应③: (g)+
(g)+ (g)
(g) 2
2 (g) ΔH3
(g) ΔH3
方法二: (g)+2HI
(g)+2HI
 (g)+I2(g) ΔH4=-89.3 kJ·mol-1
(g)+I2(g) ΔH4=-89.3 kJ·mol-1
①平衡时HI的体积分数为
②用平衡分压代替平衡浓度计算压强平衡常数KP=
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡
Ⅱ.环戊二烯(C5H6)容易二聚生成双环戊二烯(C10H12):2 (g)
(g)
 (g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。
(g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。

(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.

d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁
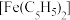 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为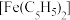 的数目为
的数目为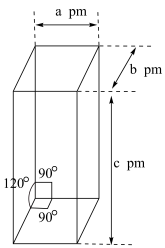
您最近一年使用:0次
2 . 下列实验操作及现象、结论有误的一项是
| 选项 | 实验方案 | 现象 | 结论或解释 |
| A | 浓硫酸与过量 充分反应后,加入 充分反应后,加入 固体 固体 |  继续溶解并产生红棕色气体 继续溶解并产生红棕色气体 | 硫酸有剩余 |
| B | 加热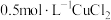 溶液 溶液 | 溶液由蓝色变为黄绿色 | [Cu(H2O)4]2++4Cl-⇌[CuCl4]2-+4H2O反应的 |
| C | 用 试纸测定等物质的量浓度的 试纸测定等物质的量浓度的 和 和 溶液的 溶液的 | 前者 大 大 | 非金属性: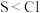 |
| D | 向 溶液中通入 溶液中通入 和气体 和气体 | 出现白色沉淀 | 气体 不一定具有氧化性 不一定具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 用乙烷为原料制备乙烯,可以降低制备成本。
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g) C2H4(g)+H2(g) ΔH。
C2H4(g)+H2(g) ΔH。
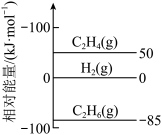
①已知:298K时,相关物质的相对能量如图:___________ 。
②___________ (填高温或低温)有利于此反应自发进行。
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g)
C2H4(g)+H2O(g)
①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g) 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是___________ 。②探究该反应的适宜条件,得到下图数据:
乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中 的变化情况。
的变化情况。
用该方法制备乙烯应该选择的适宜条件为:温度___________ ℃; =
=___________ 。
(3)温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H<0 K=2。
HCOOH(g) △H<0 K=2。
①实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=___________ k逆。
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强___________ (填“大于”“小于”或“等于”)T1℃时平衡压强,判断依据是___________ 。
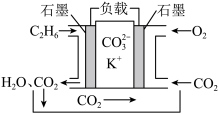
(4)某乙烷熔融燃料电池工作原理如下图所示:___________ 。
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g)
 C2H4(g)+H2(g) ΔH。
C2H4(g)+H2(g) ΔH。①已知:298K时,相关物质的相对能量如图:
②
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g)
C2H4(g)+H2O(g)①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g)
 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中
 的变化情况。
的变化情况。用该方法制备乙烯应该选择的适宜条件为:温度
 =
=(3)温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H<0 K=2。
HCOOH(g) △H<0 K=2。①实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(4)某乙烷熔融燃料电池工作原理如下图所示:
您最近一年使用:0次
4 . 已知: ,向恒温恒容的密闭容器中充入
,向恒温恒容的密闭容器中充入 和
和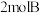 发生反应,
发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
 ,向恒温恒容的密闭容器中充入
,向恒温恒容的密闭容器中充入 和
和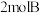 发生反应,
发生反应, 时达到平衡状态Ⅰ,在
时达到平衡状态Ⅰ,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。
| A.容器内压强不变,表明反应达到平衡 |
B.平衡常数 Ⅱ Ⅱ Ⅰ Ⅰ |
C. 时改变的条件:向容器中加入C 时改变的条件:向容器中加入C |
D.平衡时 的体积分数 的体积分数 Ⅱ Ⅱ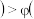 Ⅰ Ⅰ |
您最近一年使用:0次
5 . 在密闭容器中进行反应: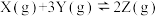 ,有关下列图像的说法错误的是
,有关下列图像的说法错误的是
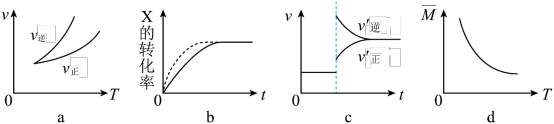
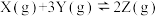 ,有关下列图像的说法错误的是
,有关下列图像的说法错误的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H>0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
您最近一年使用:0次
6 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=-746.5kJ/mol。
(1)某研究小组在三个容积为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:(填"<"、">""或"=",)

①温度:T1_______ T2.
②CO的平衡转化率:I_______ Ⅱ_______ Ⅲ
③反应速率:a点的v逆_______ b点的v正
④T2时的平衡常数K=_______ 。
(2)将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即NO的转化率)如图所示。M点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,说明理由_______ 。

(1)某研究小组在三个容积为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:(填"<"、">""或"=",)

①温度:T1
②CO的平衡转化率:I
③反应速率:a点的v逆
④T2时的平衡常数K=
(2)将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即NO的转化率)如图所示。M点

您最近一年使用:0次
7 . 一个真空密闭恒容容器中盛有amolPCl5,加热到200℃发生如下反应:PCl5(g)⇌PCl3(g)+Cl2(g),反应达到平衡时,混合气体中PCl3所占体积分数为M%。若同一温度的同一容器中,最初投入2amolPCl5,反应达平衡时,混合气体中PCl3所占体积分数为N%。则M和N的关系是
| A.M>N | B.M=N | C.M<N | D.无法确定 |
您最近一年使用:0次
8 . 下列有关合成氨工业的叙述,不可用勒夏特列原理来解释的是
| A.将NO2和N2O4的混合气体加压后,颜色先变深后变浅 |
| B.高压比常压条件更有利于合成氨的反应 |
| C.低温更有利于合成氨的反应 |
| D.使用铁触媒,使N2和H2混合气体有利于合成氨 |
您最近一年使用:0次
名校
9 . 大气中二氧化碳 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
相关主要反应有:
①
②

③

④

⑤

回答下列问题:
(1)通过 与
与 和
和 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
___________ 。
(2)下图显示了在 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是___________ 。

(3)其他条件不变, 时(如右图),
时(如右图), 和
和 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是___________ 。在 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为___________ (已知:二甲苯的选择性 ,产率=转化率×选择性)。
,产率=转化率×选择性)。
(4)该工艺采用 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使___________ ,致使反应速率下降。
(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表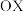 :
: 。则反应
。则反应 的
的
___________ 0,(填“>”或“<”)判断依据是___________ 。

 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。相关主要反应有:
①

②


③


④


⑤


回答下列问题:
(1)通过
 与
与 和
和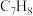 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
(2)下图显示了在
 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是
(3)其他条件不变,
 时(如右图),
时(如右图), 和
和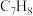 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为 ,产率=转化率×选择性)。
,产率=转化率×选择性)。(4)该工艺采用
 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯
 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表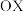 :
: 。则反应
。则反应 的
的

您最近一年使用:0次
名校
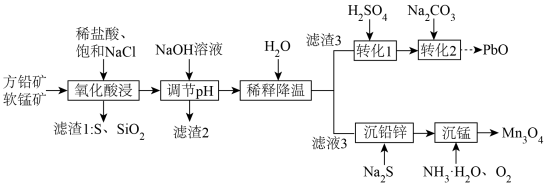
10 . 一种以方铅矿(主要成分为 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:① 。
。
②常温下,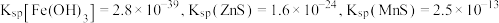 ,
, 。
。
(1) 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是___________ (填元素符号)。
(2)“氧化酸浸”时, 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为___________ 。随着温度的升高,各元素的浸出率变化如图所示,当温度高于 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是___________ 。

(3)“调节 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分___________ 。
(4)结合平衡移动原理,解释“稀释降温”的目的:___________ 。
(5)“滤液3”中的金属阳离子除了少量 外,还有
外,还有___________ 。
(6)常温下,用 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为___________  (设
(设 的平衡浓度为
的平衡浓度为 )。
)。
(7)一定条件下,写出“沉锰”制备 的化学方程式
的化学方程式___________ 。
 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:①
 。
。②常温下,
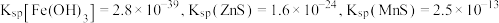 ,
, 。
。(1)
 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是(2)“氧化酸浸”时,
 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是
(3)“调节
 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分(4)结合平衡移动原理,解释“稀释降温”的目的:
(5)“滤液3”中的金属阳离子除了少量
 外,还有
外,还有(6)常温下,用
 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为 (设
(设 的平衡浓度为
的平衡浓度为 )。
)。(7)一定条件下,写出“沉锰”制备
 的化学方程式
的化学方程式
您最近一年使用:0次



