名校
1 . 氢气是一种清洁能源,研究制氢技术具有重要意义。
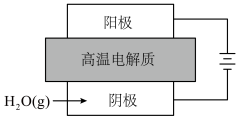
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。___________ (用电极反应式表示)。
②电解质常选用铈( )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为___________ 。 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是___________ 。
(2)乙醇-水催化重整可获得 。其主要反应为:
。其主要反应为:
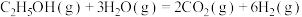
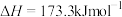

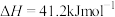
在 、
、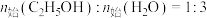 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 的
的
___________  。
。
②平衡时, 的产率随温度的变化为
的产率随温度的变化为___________ 。
(3)在“ ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。 的
的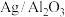 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是___________ 。
ii.若用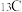 标记乙醇
标记乙醇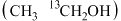 ,最终产物中含
,最终产物中含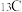 的物质化学式为
的物质化学式为___________ 。
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的
 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。
②电解质常选用铈(
 )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为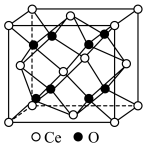
 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是(2)乙醇-水催化重整可获得
 。其主要反应为:
。其主要反应为: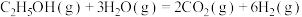
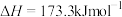

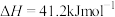
在
 、
、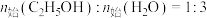 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。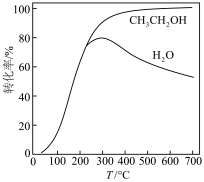
 的
的
 。
。②平衡时,
 的产率随温度的变化为
的产率随温度的变化为(3)在“
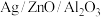 ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。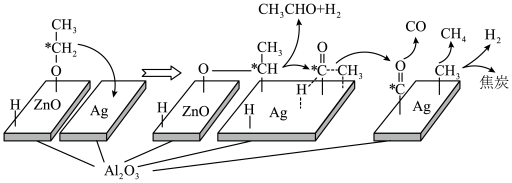
 的
的 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是ii.若用
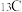 标记乙醇
标记乙醇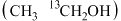 ,最终产物中含
,最终产物中含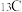 的物质化学式为
的物质化学式为
您最近一年使用:0次
7日内更新
|
131次组卷
|
2卷引用:2024届江苏省新高考基地学校高三下学期第五次大联考化学试题
2 . 化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述错误的是
|
|
|
|
 |  |  |  |
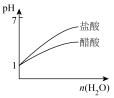
A.图 可表示 可表示 酸性溶液与过量的 酸性溶液与过量的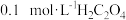 溶液混合时, 溶液混合时, 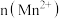 随时间的变化 随时间的变化 |
B.图 可表示体积相等、 可表示体积相等、 的醋酸溶液与盐酸加入等量水稀释时的 的醋酸溶液与盐酸加入等量水稀释时的 变化 变化 |
C.图 可表示温度对可逆反应 可表示温度对可逆反应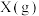  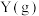 , , 的影响 的影响 |
D.图 可表示压强对可逆反应 可表示压强对可逆反应  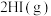 的影响 的影响 |
您最近一年使用:0次
3 . 纳米级材料Cu2O有非常优良的催化性能。工业上在高温条件下用炭粉还原CuO制得: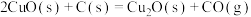
 。下列说法正确的是
。下列说法正确的是
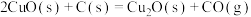
 。下列说法正确的是
。下列说法正确的是| A.该反应在任何温度下均可自发进行 |
| B.该反应的平衡常数K=c(CO) |
| C.其他条件相同,加入更多的炭粉,可以提高CuO的平衡转化率 |
| D.反应中生成22.4L,转移的电子数目为2×6.02×1023 |
您最近一年使用:0次
名校
4 . 已知CH4-CO2重整制氢的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ: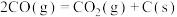

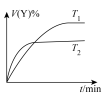
 下,将
下,将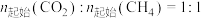 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:
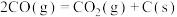

 下,将
下,将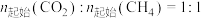 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是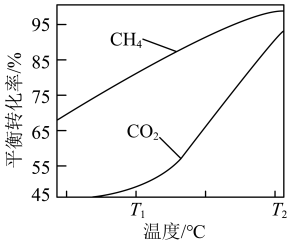
A.由图可知 |
| B.向重整体系中通入适量的H2O(g),不能减少C(s)的生成 |
| C.选择合适的催化剂可以提高T1时CH4的平衡转化率 |
D.相对 时, 时, 温度下 温度下 和 和 的转化率接近的主要原因是从 的转化率接近的主要原因是从 到 到 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 |
您最近一年使用:0次
5 . 在一定容积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为________ 。
 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
解题方法
6 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
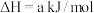
②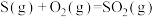
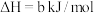
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
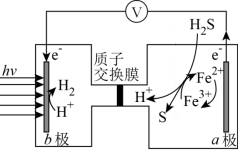
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

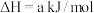
②
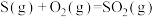
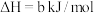
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近一年使用:0次
名校
7 . 汽车尾气的转化反应之一为: 若反应在容积为
若反应在容积为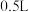 的密闭容器中进行,由该反应相关图像作出的判断正确的是
的密闭容器中进行,由该反应相关图像作出的判断正确的是
 若反应在容积为
若反应在容积为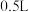 的密闭容器中进行,由该反应相关图像作出的判断正确的是
的密闭容器中进行,由该反应相关图像作出的判断正确的是
| A.由图像甲可知,该反应正反应为吸热反应 |
B.由图像乙可知,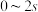 内平均速率 内平均速率 |
C.由图像丙可知,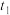 时改变的条件可能为增大压强 时改变的条件可能为增大压强 |
D.由图像丁中,若 为 为 ,则纵坐标 ,则纵坐标 可能为 可能为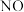 的转化率 的转化率 |
您最近一年使用:0次
2024-04-27更新
|
160次组卷
|
2卷引用:江苏省射阳中学2023-2024学年高二下学期3月月考化学试题
解题方法
8 .  催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅰ:
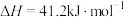
反应Ⅱ: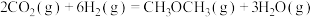
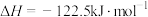
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示。(
的选择性随温度的变化如下图所示。( 的选择性
的选择性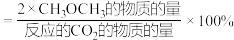 )
)
下列说法不正确 的是
 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:反应Ⅰ:

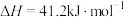
反应Ⅱ:
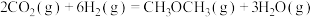
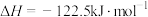
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示。(
的选择性随温度的变化如下图所示。( 的选择性
的选择性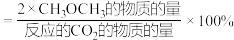 )
)下列说法
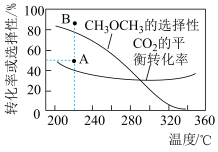
A.在240~320℃范围内,温度升高,平衡时 的物质的量先增大后减小 的物质的量先增大后减小 |
B.反应 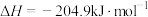 |
C.其他条件不变时,温度越高, 主要还原产物中碳元素的价态越高 主要还原产物中碳元素的价态越高 |
D.反应一段时间后,测得 的选择性为48%(图中A点),增大压强可能将 的选择性为48%(图中A点),增大压强可能将 的选择性提升到B点 的选择性提升到B点 |
您最近一年使用:0次
名校
9 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: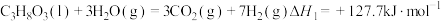
反应Ⅱ: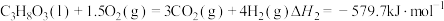
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积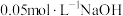 溶液和
溶液和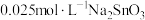 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为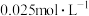 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。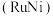 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用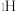 、
、 和
和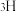 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
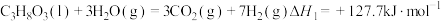
反应Ⅱ:
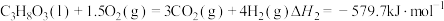
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积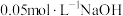 溶液和
溶液和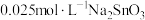 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是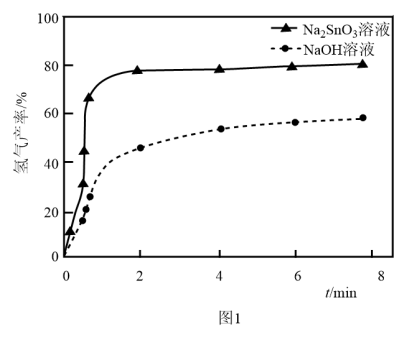
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为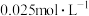 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是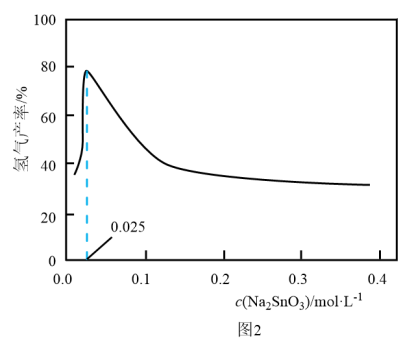
 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用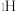 、
、 和
和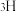 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为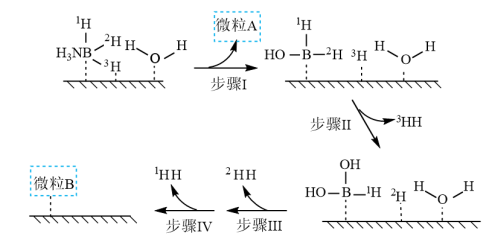
您最近一年使用:0次
10 . 空气中 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。
(1)利用高炉炼铁尾气中的 制取有机物的过程如下:
制取有机物的过程如下: 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: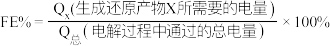 ,选择性
,选择性 .
.
“电解”在质子交换膜电解池中进行,生成 的电极反应式为
的电极反应式为____________ ,当电解电压为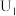 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为____________ .
(2)利用铟氧化物催化 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,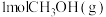 和
和 放出
放出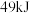 的热量,其热化学方程式为
的热量,其热化学方程式为____________ .
②若原料气中 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是____________ .
③制取 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者____________ 后者(选填“>”、“=”或“<”);保持气体流速不变,反应管内温度从 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是____________ .
 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)利用高炉炼铁尾气中的
 制取有机物的过程如下:
制取有机物的过程如下: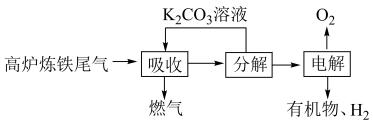
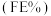 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: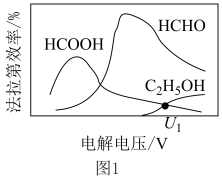
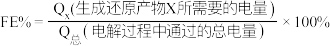 ,选择性
,选择性 .
.“电解”在质子交换膜电解池中进行,生成
 的电极反应式为
的电极反应式为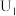 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为(2)利用铟氧化物催化
 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,
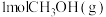 和
和 放出
放出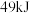 的热量,其热化学方程式为
的热量,其热化学方程式为②若原料气中
 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是③制取
 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是
您最近一年使用:0次