1 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应Ⅰ:
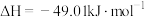
反应Ⅱ:
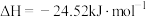
反应Ⅲ:
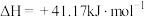
①结合计算分析反应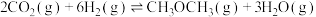 的自发性:
的自发性:___________ 。
②恒压、投料比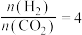 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
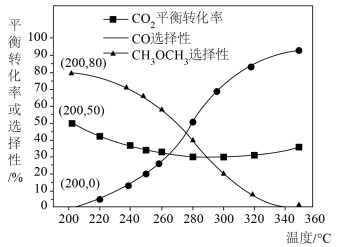
当温度超过 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
③工业实际设计温度一般在 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是___________ 。
(2)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。
① 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(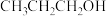 )的电极反应方程式为
)的电极反应方程式为___________ 。
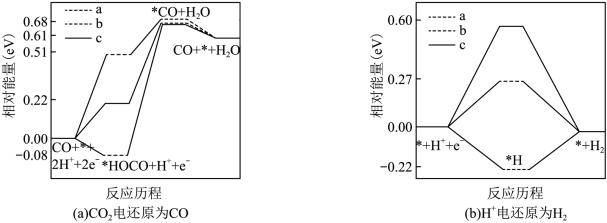
②在电解质水溶液中,三种不同催化剂( 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用 、
、 、
、 字母排序)。
字母排序)。
(3) 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,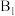 、
、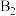 位点带部分负电荷)。
位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应Ⅰ:

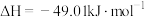
反应Ⅱ:

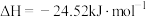
反应Ⅲ:

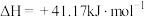
①结合计算分析反应
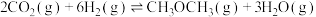 的自发性:
的自发性:②恒压、投料比
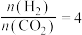 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
当温度超过
 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是③工业实际设计温度一般在
 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是(2)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。①
 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(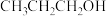 )的电极反应方程式为
)的电极反应方程式为②在电解质水溶液中,三种不同催化剂(
 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为 、
、 、
、 字母排序)。
字母排序)。
(3)
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,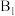 、
、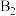 位点带部分负电荷)。
位点带部分负电荷)。
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
名校
2 . 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同, 环状分子的结构为
环状分子的结构为 。合理应用和处理含硫的化合物,在生产生活中有重要意义。利用甲烷可以除去
。合理应用和处理含硫的化合物,在生产生活中有重要意义。利用甲烷可以除去 ,反应为
,反应为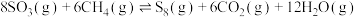 。下列说法正确的是
。下列说法正确的是
A. 分子中硫原子采用 分子中硫原子采用 杂化 杂化 |
B.上述反应的 |
C.上述反应的化学平衡常数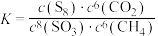 |
D.及时分离出 ,正反应速率增大,平衡向正反应方向移动 ,正反应速率增大,平衡向正反应方向移动 |
您最近一年使用:0次
2024-01-21更新
|
321次组卷
|
4卷引用:江苏省泰州中学、宿迁中学、宜兴中学2023-2024学年高三上学期12月调研测试化学试卷
江苏省泰州中学、宿迁中学、宜兴中学2023-2024学年高三上学期12月调研测试化学试卷江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷江西省景德镇市乐平中学2023-2024学年高二下学期3月月考化学试题(已下线)江苏省南京师范大学附属中学2024届高三下学期三模考试化学试题
名校
解题方法
3 . 回收锑冶炼厂的砷碱渣中砷的过程可表示为:

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是_______ 。
(2)“沉砷”过程发生反应: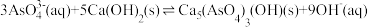 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为_______ (用含a、b的表达式作答)。
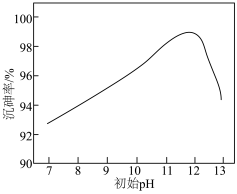
(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是_______ 。
(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为_______ 。
② Na2S须过量,原因是_______ 。
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为_______ 。
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为_______ 。

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是
(2)“沉砷”过程发生反应:
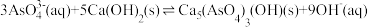 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是

(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为
② Na2S须过量,原因是
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为
您最近一年使用:0次
名校
4 . 二氧化碳加氢制甲烷过程中的主要反应为
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·mol-1
在密闭容器中,1.01×105Pa,n起始(CO2):n起始(H2)=1:4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。

CH4的选择性可表示为 ×100%。
×100%。
下列说法正确的是
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·mol-1
在密闭容器中,1.01×105Pa,n起始(CO2):n起始(H2)=1:4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。

CH4的选择性可表示为
 ×100%。
×100%。下列说法正确的是
| A.反应2CO(g)+2H2(g)=CO2(g)+CH4(g)的焓变ΔH=-205.9kJ·mol-1 |
| B.CH4的平衡选择性随着温度的升高而减少 |
| C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ |
D.450℃时,提高 的值或增大压强,均能使CO₂平衡转化率达到X点的值 的值或增大压强,均能使CO₂平衡转化率达到X点的值 |
您最近一年使用:0次
解题方法
5 . 反应: (g)+CO2(g)→
(g)+CO2(g)→ (g)+H2O(g)+CO(g)
(g)+H2O(g)+CO(g)  <0,反应历程如图所示,其中步骤①③为慢速反应,步骤②为快速反应。下列有关说法不正确的是
<0,反应历程如图所示,其中步骤①③为慢速反应,步骤②为快速反应。下列有关说法不正确的是

 (g)+CO2(g)→
(g)+CO2(g)→ (g)+H2O(g)+CO(g)
(g)+H2O(g)+CO(g)  <0,反应历程如图所示,其中步骤①③为慢速反应,步骤②为快速反应。下列有关说法不正确的是
<0,反应历程如图所示,其中步骤①③为慢速反应,步骤②为快速反应。下列有关说法不正确的是
| A.该反应在该条件下可自发进行 | B.体系温度升高平衡常数减小 |
| C.该催化剂不会吸附羟基上的氢原子 | D.步骤①③决定了整体反应速率 |
您最近一年使用:0次
名校
解题方法
6 . 碘甲烷(CH3I)可裂解制取低碳烯烃。碘甲烷裂解时可发生如下反应:
反应1:2CH3I(g) C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1
C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1
反应2:3C2H4(g) 2C3H6(g) ΔH=−108.1 kJ·mol-1
2C3H6(g) ΔH=−108.1 kJ·mol-1
反应3:2C2H4(g) C4H8(g) ΔH=−120.6 kJ·mol-1
C4H8(g) ΔH=−120.6 kJ·mol-1
向密闭容器中充入一定量的碘甲烷,维持容器内p=0.1 MPa,平衡时C2H4、C3H6和C4H8的占容器内所有气体的物质的量分数与温度的关系如下图所示。已知容器中某气体的分压p=φ(物质的量分数)×p总,用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数(Kp)。下列说法正确的是
反应1:2CH3I(g)
 C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1
C2H4(g)+2HI(g) ΔH=+80.2 kJ·mol-1反应2:3C2H4(g)
 2C3H6(g) ΔH=−108.1 kJ·mol-1
2C3H6(g) ΔH=−108.1 kJ·mol-1反应3:2C2H4(g)
 C4H8(g) ΔH=−120.6 kJ·mol-1
C4H8(g) ΔH=−120.6 kJ·mol-1向密闭容器中充入一定量的碘甲烷,维持容器内p=0.1 MPa,平衡时C2H4、C3H6和C4H8的占容器内所有气体的物质的量分数与温度的关系如下图所示。已知容器中某气体的分压p=φ(物质的量分数)×p总,用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数(Kp)。下列说法正确的是

| A.图中物质X表示的是C2H4 |
| B.700 K时,反应2的分压平衡常数Kp=3 |
| C.700 K时,从反应开始至恰好平衡,反应2的速率大于反应3的速率 |
| D.700 K时,其他条件不变,将容器内p增大为0.2 MPa,C2H4的体积分数将减小 |
您最近一年使用:0次
2024-01-14更新
|
220次组卷
|
3卷引用:江苏省常州市第一中学2023-2024学年高二上学期12月月考化学试题
名校
7 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的 ,其部分实验过程如下:
,其部分实验过程如下:
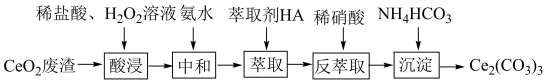
(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为___________
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。
①得到含 量较少的
量较少的 的加料方式为
的加料方式为___________ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
② 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:___________
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是___________ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有___________ 。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的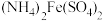 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
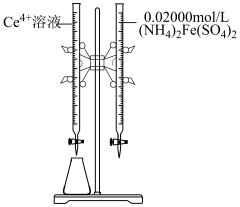
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为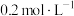 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将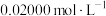
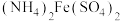 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③___________
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的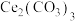 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成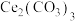 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。①得到含
 量较少的
量较少的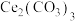 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中②
 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的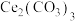 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的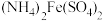 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为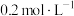 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将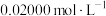
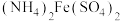 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近一年使用:0次
名校
解题方法
8 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为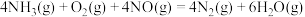

(1)催化剂___________ 改变ΔH(填“能”或“不能”)
(2)催化剂的制备。将预先制备的一定量的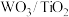 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为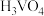 沉淀的离子方程式为
沉淀的离子方程式为___________ ;
(3)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
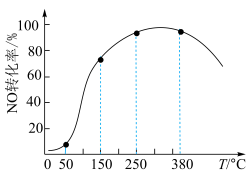
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:___________
(4)废催化剂的回收。回收 催化剂并制备
催化剂并制备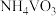 的过程可表示为
的过程可表示为

①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
②向pH=8的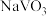 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知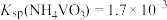 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
(5)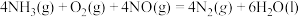 ΔH
ΔH___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为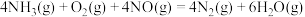

(1)催化剂
(2)催化剂的制备。将预先制备的一定量的
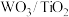 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为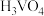 沉淀的离子方程式为
沉淀的离子方程式为(3)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:
(4)废催化剂的回收。回收
 催化剂并制备
催化剂并制备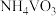 的过程可表示为
的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
②向pH=8的
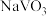 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知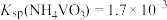 ,加过量
,加过量 溶液的目的是
溶液的目的是(5)
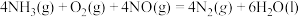 ΔH
ΔH (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近一年使用:0次
名校
9 . 对于反应
 。下列说法正确的是
。下列说法正确的是

 。下列说法正确的是
。下列说法正确的是A.只要氧气过量,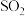 就可以实现转化率100% 就可以实现转化率100% |
| B.其他条件不变,升高体系的温度,该反应的平衡常数K增大 |
C.保持其他条件不变,增大 浓度能提高 浓度能提高 的反应速率和转化率 的反应速率和转化率 |
| D.使用催化剂能改变反应途径,不能改变反应的活化能 |
您最近一年使用:0次
名校
10 . 乙醇-水催化重整可获得 ,其主要反应为:
,其主要反应为: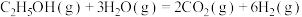
 ,
,
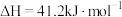 ,在
,在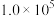 Pa下,当乙醇和水的物质的量之比为1:3时,若仅考虑上述反应,平衡时
Pa下,当乙醇和水的物质的量之比为1:3时,若仅考虑上述反应,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图所示。下列说法不正确的是
的产率随温度的变化如图所示。下列说法不正确的是

 ,其主要反应为:
,其主要反应为: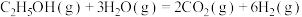
 ,
,
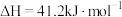 ,在
,在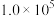 Pa下,当乙醇和水的物质的量之比为1:3时,若仅考虑上述反应,平衡时
Pa下,当乙醇和水的物质的量之比为1:3时,若仅考虑上述反应,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图所示。下列说法不正确的是
的产率随温度的变化如图所示。下列说法不正确的是
A.图中曲线①表示平衡时 选择性随温度的变化 选择性随温度的变化 |
B.升高温度,平衡时 产率和CO选择性均增大 产率和CO选择性均增大 |
C.一定温度下,增大 或适当减压,均可提高乙醇平衡转化率 或适当减压,均可提高乙醇平衡转化率 |
D.一定温度下,加入少量生石灰或者熟石灰固体,均能提高平衡时 产率 产率 |
您最近一年使用:0次
2024-01-01更新
|
338次组卷
|
2卷引用:江苏省盐城市东台中学2023-2024学年高三下学期3月月考化学试题



