名校
1 . 用一碘甲烷 热裂解制取低碳烯烃的主要反应有:
热裂解制取低碳烯烃的主要反应有:
反应I:
反应Ⅱ:
反应Ⅲ:
在体积为 的恒容密闭容器中,投入
的恒容密闭容器中,投入 ,不同温度下平衡体系中
,不同温度下平衡体系中 、
、 、
、 物质的量分数随温度变化如图所示。
物质的量分数随温度变化如图所示。不正确 的是
 热裂解制取低碳烯烃的主要反应有:
热裂解制取低碳烯烃的主要反应有:反应I:

反应Ⅱ:

反应Ⅲ:

在体积为
 的恒容密闭容器中,投入
的恒容密闭容器中,投入 ,不同温度下平衡体系中
,不同温度下平衡体系中 、
、 、
、 物质的量分数随温度变化如图所示。
物质的量分数随温度变化如图所示。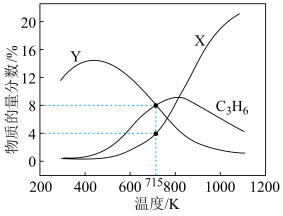
A. |
B.曲线X表示 的物质的量分数 的物质的量分数 |
C. 以前,温度对反应Ⅱ的影响是 以前,温度对反应Ⅱ的影响是 物质的量分数变化的主要因素 物质的量分数变化的主要因素 |
D. 的平衡体系中, 的平衡体系中, 的物质的量分数为 的物质的量分数为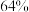 |
您最近一年使用:0次
2 . 研究 的回收和综合利用对航天建设有重要意义。
的回收和综合利用对航天建设有重要意义。
(1)回收利用 是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
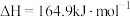 ,该反应是回收利用
,该反应是回收利用 的关键步骤。将原料按
的关键步骤。将原料按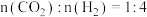 置于恒容密闭容器中发生反应A,在相同时间内测得
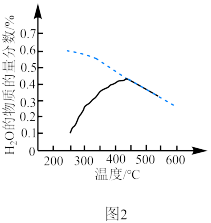
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是___________ 。
②用 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
(2)利用 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:
I.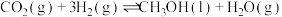
II.
一定条件下向某刚性容器中充入物质的量之比为 的
的 和
和 发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间,
发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间, 转化率和甲醇的选择性[甲醇的选择
转化率和甲醇的选择性[甲醇的选择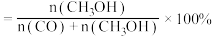 ]随温度变化如图3所示:
]随温度变化如图3所示:___________ cat2(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②某条件下,达到平衡时 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 ,反应II的平衡常数
,反应II的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压 总压
总压 平衡时物质的量分数,保留1位有效数字)
平衡时物质的量分数,保留1位有效数字)
(3)科学家设计了一种新的 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如图4:
的难储存问题,装置如图4:___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为 溶液,对合成甲醇造成的不良后果是
溶液,对合成甲醇造成的不良后果是___________ 。
(4)科研人员提出 催化
催化 合成碳酸二甲酯(DMC),从而实现
合成碳酸二甲酯(DMC),从而实现 的综合利用。图5为理想的
的综合利用。图5为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为___________ 。
 的回收和综合利用对航天建设有重要意义。
的回收和综合利用对航天建设有重要意义。(1)回收利用
 是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1:
是目前解决长期载人航天舱内供氧问题的有效途径,科研人员研究出其物质转化途径如图1: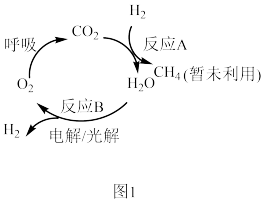

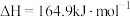 ,该反应是回收利用
,该反应是回收利用 的关键步骤。将原料按
的关键步骤。将原料按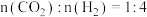 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
的物质的量分数与温度的变化曲线如图2(虚线为平衡时的曲线)。空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是②用
 代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是(2)利用
 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:I.
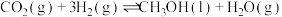
II.

一定条件下向某刚性容器中充入物质的量之比为
 的
的 和
和 发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间,
发生上述反应,在不同催化剂(cat1,cat2)下经相同反应时间, 转化率和甲醇的选择性[甲醇的选择
转化率和甲醇的选择性[甲醇的选择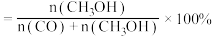 ]随温度变化如图3所示:
]随温度变化如图3所示:
 ”“
”“ ”或“
”或“ ”)。
”)。②某条件下,达到平衡时
 的转化率为
的转化率为 ,
, 的选择性为
的选择性为 ,反应II的平衡常数
,反应II的平衡常数
 总压
总压 平衡时物质的量分数,保留1位有效数字)
平衡时物质的量分数,保留1位有效数字)(3)科学家设计了一种新的
 可循环系统,可以实现温室气体的零排放,同时也回避了
可循环系统,可以实现温室气体的零排放,同时也回避了 的难储存问题,装置如图4:
的难储存问题,装置如图4: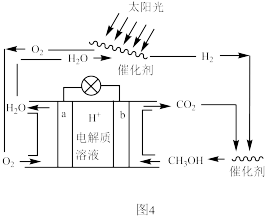
②b电极上的电极反应式为
 溶液,对合成甲醇造成的不良后果是
溶液,对合成甲醇造成的不良后果是(4)科研人员提出
 催化
催化 合成碳酸二甲酯(DMC),从而实现
合成碳酸二甲酯(DMC),从而实现 的综合利用。图5为理想的
的综合利用。图5为理想的 的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为
的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷如6,该缺陷晶型的化学式可表示为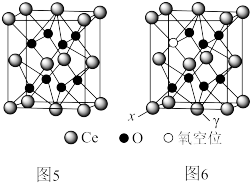
您最近一年使用:0次
解题方法
3 . 利用 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:
反应I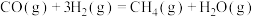

反应II
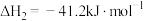
向密闭容器中充入一定量 和CO发生上述反应,保持温度和容器体积一定,平衡时CO和
和CO发生上述反应,保持温度和容器体积一定,平衡时CO和 的转化率、
的转化率、 和
和 的产率及随起始
的产率及随起始 的变化情况如下图所示。 [
的变化情况如下图所示。 [ 的产率
的产率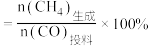 ,
, 的选择性
的选择性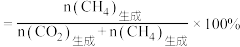 ]。
]。
 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:反应I
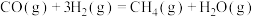

反应II

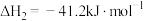
向密闭容器中充入一定量
 和CO发生上述反应,保持温度和容器体积一定,平衡时CO和
和CO发生上述反应,保持温度和容器体积一定,平衡时CO和 的转化率、
的转化率、 和
和 的产率及随起始
的产率及随起始 的变化情况如下图所示。 [
的变化情况如下图所示。 [ 的产率
的产率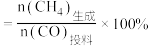 ,
, 的选择性
的选择性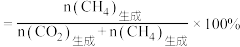 ]。
]。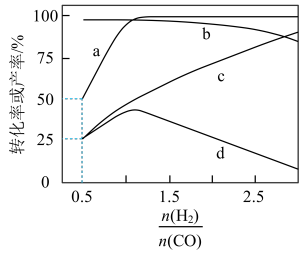
A.随着 增大, 增大, 的选择性一直在减小 的选择性一直在减小 |
B.曲线d表示 的产率随 的产率随 的变化 的变化 |
C.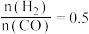 ,反应达平衡时, ,反应达平衡时, 的选择性为 的选择性为 |
| D.当容器内气体总压强保持不变时,反应I、II不一定达到平衡状态 |
您最近一年使用:0次
名校
解题方法
4 . 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式:
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=﹣164.7kJ•mol﹣1;
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ•mol﹣1;
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g)△H=﹣247.1kJ•mol﹣1。
向恒压、密闭容器中通入1mol CO2和4mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=﹣164.7kJ•mol﹣1;
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ•mol﹣1;
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g)△H=﹣247.1kJ•mol﹣1。
向恒压、密闭容器中通入1mol CO2和4mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是

A.反应II的平衡常数可表示为K=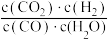 |
| B.图中曲线B表示CO的物质的量随温度的变化 |
| C.该反应最佳控制温度在800℃~1000℃之间 |
| D.提高CO2转化为CH4的转化率,需要研发在低温区高效的催化剂 |
您最近一年使用:0次
名校
5 . “碳达峰·碳中和”是我国社会发展的重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关主要反应有:
Ⅰ:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247kJ/mol,K1
2CO(g)+2H2(g) ΔH1=+247kJ/mol,K1
Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol,K2
CO(g)+H2O(g) ΔH2=+41kJ/mol,K2
下列说法正确的是
Ⅰ:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247kJ/mol,K1
2CO(g)+2H2(g) ΔH1=+247kJ/mol,K1Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41kJ/mol,K2
CO(g)+H2O(g) ΔH2=+41kJ/mol,K2下列说法正确的是
A.反应Ⅰ的平衡常数K1=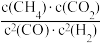 |
| B.反应Ⅱ的ΔS<0 |
| C.有利于提高CO2平衡转化率的条件是高温低压 |
| D.该工艺每转化0.2mol CO2可获得0.4molCO |
您最近一年使用:0次
6 . 吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。
(1)ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图-1所示。
的物质的量分数随pH的分布如图-1所示。___________ (填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为___________ 。
②O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围 内,pH越低SO 生成速率越大,其主要原因是
生成速率越大,其主要原因是___________ 。
(2)镁法工业烟气脱硫并制备MgSO4·H2O,其过程可表示为:___________ ;下列实验操作一定能提高氧化镁浆料吸收SO2效率的有___________ (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入SO2气体的速率
D.通过多孔球泡向氧化镁浆料中通SO2
②在负载钴的分子筛催化剂作用下MgSO3被O2氧化为MgSO4.其他条件相同时,浆料中MgSO3被O2氧化的速率随pH的变化如图-3所示。在pH=6~8范围内,pH增大,浆料中MgSO3的氧化速率增大,其主要原因是___________ 。
步骤1:取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
步骤2:取碱式硫酸铝溶液2.50 mL,稀释至25.00 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值为___________ (写出计算过程)。
(1)ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图-1所示。
的物质的量分数随pH的分布如图-1所示。 

②O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围 内,pH越低SO
 生成速率越大,其主要原因是
生成速率越大,其主要原因是(2)镁法工业烟气脱硫并制备MgSO4·H2O,其过程可表示为:

A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入SO2气体的速率
D.通过多孔球泡向氧化镁浆料中通SO2
②在负载钴的分子筛催化剂作用下MgSO3被O2氧化为MgSO4.其他条件相同时,浆料中MgSO3被O2氧化的速率随pH的变化如图-3所示。在pH=6~8范围内,pH增大,浆料中MgSO3的氧化速率增大,其主要原因是

步骤1:取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
步骤2:取碱式硫酸铝溶液2.50 mL,稀释至25.00 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值为
您最近一年使用:0次
7 . 通过反应I:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)可将有机氯化工业的副产品HC1转化为Cl2.在0.2MPa、反应物起始物质的量比 =2条件下,不同温度时HC1平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。
=2条件下,不同温度时HC1平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。
反应III:CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH=-120.0 kJ·mol−1
下列说法正确的是
 =2条件下,不同温度时HC1平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。
=2条件下,不同温度时HC1平衡转化率如图所示。向反应体系中加入CuCl2,能加快反应速率。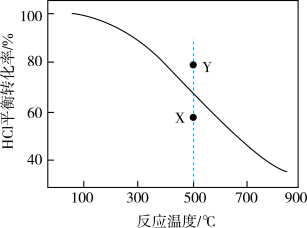
反应III:CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH=-120.0 kJ·mol−1
下列说法正确的是
| A.反应I的 ΔH=5.6 kJ·mol−1 |
| B.升高温度和增大压强均能提高反应I中HCl的平衡转化率 |
| C.0.2MPa、500℃时,向反应体系中加入CuCl2,延长反应时间,能使HCl转化率从X点的值升至Y点的值 |
D.在0.2MPa、500℃条件下,若起始 <2,充分反应,HCl的转化率可能达到Y点的值 <2,充分反应,HCl的转化率可能达到Y点的值 |
您最近一年使用:0次
8 . 利用甲醇(CH3OH)和甲苯(Tol)发生甲基化反应可以获得对二甲苯(p-X)、间二甲苯(m-X)和邻二甲苯(o-X),反应过程中还有乙烯生成,涉及的反应有
反应I

反应II

反应III

反应IV

研究发现,在密闭容器中,101kPa、 ,平衡时甲苯的转化率、反应I的选择性
,平衡时甲苯的转化率、反应I的选择性 及反应IV的选择性
及反应IV的选择性 随温度的变化如图所示。
随温度的变化如图所示。
反应I


反应II


反应III


反应IV


研究发现,在密闭容器中,101kPa、
 ,平衡时甲苯的转化率、反应I的选择性
,平衡时甲苯的转化率、反应I的选择性 及反应IV的选择性
及反应IV的选择性 随温度的变化如图所示。
随温度的变化如图所示。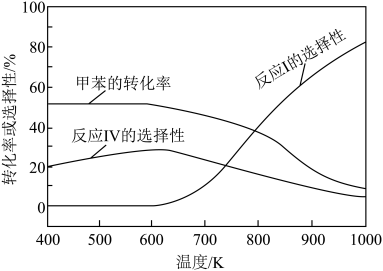
A.  |
| B.随着温度的升高,反应IV的平衡常数先增大后减小 |
C.在400~600K范围内,随着温度的升高, 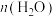 基本不变 基本不变 |
D.800K下反应达平衡后,增大压强,  保持不变 保持不变 |
您最近一年使用:0次
名校
解题方法
9 . 利用 可实现对石膏中
可实现对石膏中 元素的脱除,涉及的主要反应如下:
元素的脱除,涉及的主要反应如下:
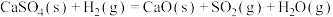
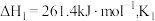

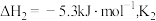
在 、
、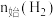 和
和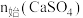 均为
均为 时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中
时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中 元素的脱除效果可用脱硫率
元素的脱除效果可用脱硫率 表示。下列说法
表示。下列说法不正确 的是
 可实现对石膏中
可实现对石膏中 元素的脱除,涉及的主要反应如下:
元素的脱除,涉及的主要反应如下: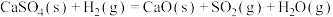
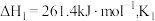

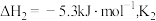
在
 、
、 和
和 均为
均为 时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中
时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中 元素的脱除效果可用脱硫率
元素的脱除效果可用脱硫率 表示。下列说法
表示。下列说法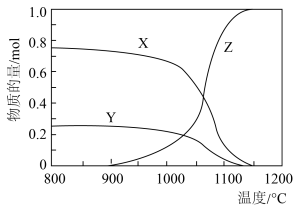
A.反应 的平衡常数 的平衡常数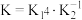 |
B.图中曲线 表示平衡时 表示平衡时 固体的物质的量随温度的变化 固体的物质的量随温度的变化 |
C.一定温度下,加入 固体或增大体系压强,均可提高平衡时的脱硫率 固体或增大体系压强,均可提高平衡时的脱硫率 |
D.其他条件不变,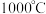 下, 下,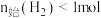 时, 时,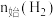 越多,平衡时的脱硫率越高 越多,平衡时的脱硫率越高 |
您最近一年使用:0次
2024-06-01更新
|
231次组卷
|
3卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
10 . 铁触媒作用下,N2和H2合成NH3的反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol−1,其反应机理可简单表示如图(*表示吸附态,中间部分表面反应过程未标出):
2NH3(g) ΔH=-92.4 kJ·mol−1,其反应机理可简单表示如图(*表示吸附态,中间部分表面反应过程未标出):
 2NH3(g) ΔH=-92.4 kJ·mol−1,其反应机理可简单表示如图(*表示吸附态,中间部分表面反应过程未标出):
2NH3(g) ΔH=-92.4 kJ·mol−1,其反应机理可简单表示如图(*表示吸附态,中间部分表面反应过程未标出):
| A.反应过程中存在非极性共价键的断裂和形成 |
| B.液化分离出产物NH3,可能利于提高合成氨反应速率 |
| C.使用铁触媒作催化剂,可降低该反应的焓变 |
| D.“加压”可加快反应速率,但氨的产率降低 |
您最近一年使用:0次



