1 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)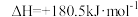 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
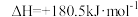 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
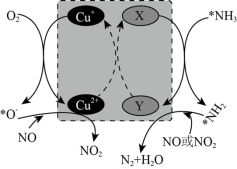
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
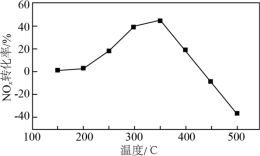
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近一年使用:0次
名校
2 . 金属硫化物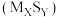 催化反应
催化反应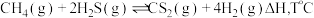 时,平衡常数为
时,平衡常数为 。该反应既可以除去天然气中的
。该反应既可以除去天然气中的 ,又可以获得
,又可以获得 。下列说法正确的是
。下列说法正确的是
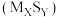 催化反应
催化反应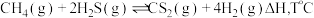 时,平衡常数为
时,平衡常数为 。该反应既可以除去天然气中的
。该反应既可以除去天然气中的 ,又可以获得
,又可以获得 。下列说法正确的是
。下列说法正确的是
A. 时,若 时,若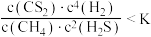 时,则 时,则 |
B.选择金属硫化物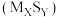 作催化剂可以提高活化分子百分数, 作催化剂可以提高活化分子百分数, 减少 减少 |
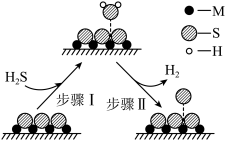
C.题图所示的反应机理中,升高温度,步骤Ⅰ中催化剂吸附 的能力一定增强 的能力一定增强 |
D.该反应中每消耗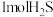 ,转移电子的数目约为 ,转移电子的数目约为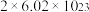 |
您最近一年使用:0次
3 . 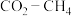 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①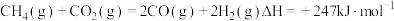
反应②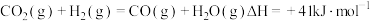
反应③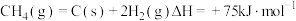
反应④
研究发现在密闭容器中 下,
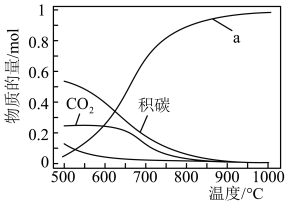
下,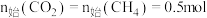 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
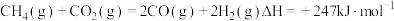
反应②
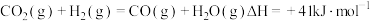
反应③
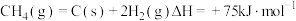
反应④

研究发现在密闭容器中
 下,
下,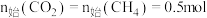 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的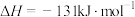 |
C.其他条件不变,在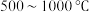 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时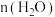 不断增大 不断增大 |
D.当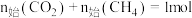 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近一年使用:0次
2024-02-13更新
|
1188次组卷
|
4卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省潍坊市2024届高高考模拟训练调研化学试题
名校
4 . 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同, 环状分子的结构为
环状分子的结构为 。合理应用和处理含硫的化合物,在生产生活中有重要意义。利用甲烷可以除去
。合理应用和处理含硫的化合物,在生产生活中有重要意义。利用甲烷可以除去 ,反应为
,反应为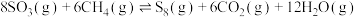 。下列说法正确的是
。下列说法正确的是
A. 分子中硫原子采用 分子中硫原子采用 杂化 杂化 |
B.上述反应的 |
C.上述反应的化学平衡常数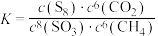 |
D.及时分离出 ,正反应速率增大,平衡向正反应方向移动 ,正反应速率增大,平衡向正反应方向移动 |
您最近一年使用:0次
2024-01-21更新
|
321次组卷
|
4卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷江苏省泰州中学、宿迁中学、宜兴中学2023-2024学年高三上学期12月调研测试化学试卷(已下线)江苏省南京师范大学附属中学2024届高三下学期三模考试化学试题江西省景德镇市乐平中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
5 . 工业上制备 ,采用碳氯化法将
,采用碳氯化法将 转化成
转化成 。在1000℃时发生反应如下:
。在1000℃时发生反应如下:
①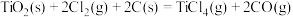

 ;
;
②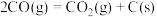

 ;
;
③

 。
。
在 ,将
,将 、
、 、
、 以物质的量之比为1:2.2:2进行碳氯化,平衡时体系中
以物质的量之比为1:2.2:2进行碳氯化,平衡时体系中 、
、 、
、 和
和 的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是

 ,采用碳氯化法将
,采用碳氯化法将 转化成
转化成 。在1000℃时发生反应如下:
。在1000℃时发生反应如下:①
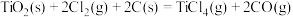

 ;
;②
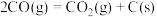

 ;
;③


 。
。在
 ,将
,将 、
、 、
、 以物质的量之比为1:2.2:2进行碳氯化,平衡时体系中
以物质的量之比为1:2.2:2进行碳氯化,平衡时体系中 、
、 、
、 和
和 的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
A.1000℃时,反应 的平衡常数 的平衡常数 |
B.曲线Ⅲ表示平衡时 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
| C.高于600℃,升高温度,主要对反应③的平衡产生影响 |
D.为保证 的平衡产率,选择反应温度在200℃即可 的平衡产率,选择反应温度在200℃即可 |
您最近一年使用:0次
2023-12-29更新
|
222次组卷
|
2卷引用:江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷
名校
6 . 化学与生产、生活和社会发展密切相关,下列叙述正确的是
| A.华为5G手机麒麟9000芯片(HUAWEIKirin)主要成分是二氧化硅 |
| B.“酒曲”的酿酒工艺,是利用了催化剂使平衡正向移动的原理 |
| C.免洗洗手液的有效成分之一活性银离子能使病毒蛋白质变性 |
| D.葛洪所著《抱朴子》中“丹砂(HgS)烧之成水银,积变又还原成丹砂”,二者为可逆反应 |
您最近一年使用:0次
2023-10-21更新
|
621次组卷
|
5卷引用:江苏省建湖高级中学2023-2024学年高二下学期期初测试(2月)化学试题
7 . 肼(N2H4)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式___________ 。
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
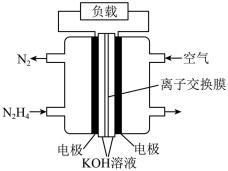
①负极的电极反应式为___________ 。
②电池工作时电子从___________ 电极经过负载后流向___________ 电极(填“左侧”或“右侧”)。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为___________ g。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):
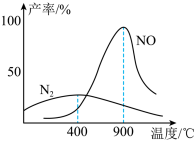
温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=________ 。
②1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是________ 。
A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为
②电池工作时电子从
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=
②1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
8 . 党的二十大报告中提出要打造“青山常在、绿水长流、空气常新”的美丽中国。工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放,
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。
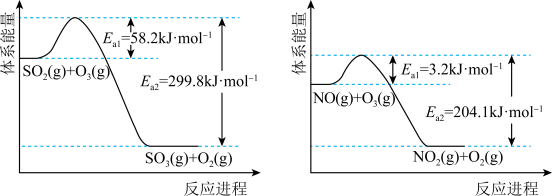
①已知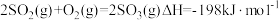 。则反应
。则反应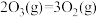 的△H
的△H__________ kJ·mol-1。
②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是__________ 。
(2)利用如图装置可同时吸收SO2和NO
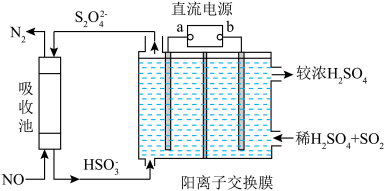
①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为__________ 。
②写出电解池中发生的总反应的离子方程式为__________ 。
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
当吸收液呈中性时,溶液中所有含硫微粒浓度由大到小的顺序为__________ 。
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。
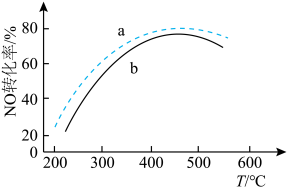
①曲线a和曲线b中,投料比较大的曲线是__________ 。
②T>450°C时,NO的转化率随温度升高而降低的原因是__________ 。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。

①已知
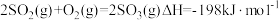 。则反应
。则反应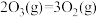 的△H
的△H②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是
(2)利用如图装置可同时吸收SO2和NO

①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
②写出电解池中发生的总反应的离子方程式为
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:n(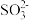 ):n( ):n(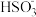 ) ) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。

①曲线a和曲线b中,投料比较大的曲线是
②T>450°C时,NO的转化率随温度升高而降低的原因是
您最近一年使用:0次
9 . 金属铬耐腐蚀,可做镀层金属, 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;
(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠( 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:

反应池中发生反应的离子方程式_____ 。
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是_____ 。
③室温下,加入石灰乳调节pH,当 时,pH>
时,pH>_____ 。
(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
(ii)依据如下两个图示信息,上述实验3降解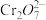 效率增大的原因是
效率增大的原因是_____ 。

(3)电解除铬法:
已知:电解除铬过程中主要反应: ;
;

①图3中气体a的主要成分是_____ 。
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是_____ 。
 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠(
 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
反应池中发生反应的离子方程式
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
③室温下,加入石灰乳调节pH,当
 时,pH>
时,pH>(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的
 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。| 实验编号 | 纳米Fe(g/L) | Fe3O4 (g/L) |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
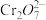 效率增大的原因是
效率增大的原因是
(3)电解除铬法:
已知:电解除铬过程中主要反应:
 ;
;
①图3中气体a的主要成分是
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是
您最近一年使用:0次
10 .  资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
Ⅰ. 制甲醇,过程如下:
制甲醇,过程如下:
i.催化剂活化: (无活性)
(无活性)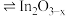 (有活性)
(有活性)
ii. 与
与 在活化后的催化剂表面可逆的发生如下反应:
在活化后的催化剂表面可逆的发生如下反应:
反应①:
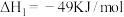 ,其反应历程如图;
,其反应历程如图;
反应②:
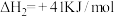 。
。
已知: 选择性
选择性 。
。
(1) 制甲醇的过程中,为同时提高
制甲醇的过程中,为同时提高 平衡转化率和
平衡转化率和 的选择性,可采取的措施为
的选择性,可采取的措施为___________ 。
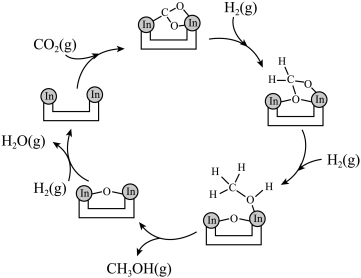
(2)关于反应①历程,以下描述正确的是___________。(填序号)。
(3) 与
与 混合气体以不同流速通过反应器,气体流速与
混合气体以不同流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图:
选择性的关系如图:

①其他条件不变,气体流速较慢可造成 的积累,使催化剂失活,用化学方程式表示催化剂失活的原因:
的积累,使催化剂失活,用化学方程式表示催化剂失活的原因:___________ 。
②其他条件不变,气体流速加快, 转化率、
转化率、 选择性变化的原因是
选择性变化的原因是___________ 。
Ⅱ.一种以甲醇和二氧化碳为主要原料,利用 和CuO纳米片(CuONS/CF)作催化电极,电化学法制备甲酸的工作原理如图所示 (已知电解时甲醇难在电极上直接放电):
和CuO纳米片(CuONS/CF)作催化电极,电化学法制备甲酸的工作原理如图所示 (已知电解时甲醇难在电极上直接放电):
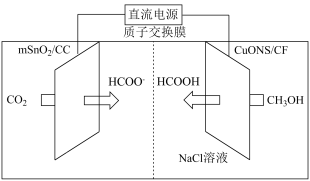
(4)①加入NaCl溶液的作用是___________ 。
②若有4mol 通过质子交换膜,将阴阳极溶液混合并酸化,理论获得HCOOH
通过质子交换膜,将阴阳极溶液混合并酸化,理论获得HCOOH___________ mol。
 资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
资源化利用是解决资源和能源短缺、减少碳排放的一种途径。Ⅰ.
 制甲醇,过程如下:
制甲醇,过程如下:i.催化剂活化:
 (无活性)
(无活性)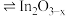 (有活性)
(有活性)ii.
 与
与 在活化后的催化剂表面可逆的发生如下反应:
在活化后的催化剂表面可逆的发生如下反应:反应①:

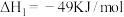 ,其反应历程如图;
,其反应历程如图;反应②:

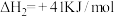 。
。已知:
 选择性
选择性 。
。
(1)
 制甲醇的过程中,为同时提高
制甲醇的过程中,为同时提高 平衡转化率和
平衡转化率和 的选择性,可采取的措施为
的选择性,可采取的措施为(2)关于反应①历程,以下描述正确的是___________。(填序号)。
| A.反应物键能之和大于生成物键能之和 |
| B.以上过程中经历了In—C、In-O键的形成和断裂 |
C. 无活性的可能原因是 无活性的可能原因是 结构中缺少氧空位 结构中缺少氧空位 |
| D.原料气中添加少量CO主要目的是为了抑制反应②进行 |
 与
与 混合气体以不同流速通过反应器,气体流速与
混合气体以不同流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图:
选择性的关系如图:
①其他条件不变,气体流速较慢可造成
 的积累,使催化剂失活,用化学方程式表示催化剂失活的原因:
的积累,使催化剂失活,用化学方程式表示催化剂失活的原因:②其他条件不变,气体流速加快,
 转化率、
转化率、 选择性变化的原因是
选择性变化的原因是Ⅱ.一种以甲醇和二氧化碳为主要原料,利用
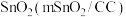 和CuO纳米片(CuONS/CF)作催化电极,电化学法制备甲酸的工作原理如图所示 (已知电解时甲醇难在电极上直接放电):
和CuO纳米片(CuONS/CF)作催化电极,电化学法制备甲酸的工作原理如图所示 (已知电解时甲醇难在电极上直接放电):
(4)①加入NaCl溶液的作用是
②若有4mol
 通过质子交换膜,将阴阳极溶液混合并酸化,理论获得HCOOH
通过质子交换膜,将阴阳极溶液混合并酸化,理论获得HCOOH
您最近一年使用:0次



