1 . 在一定容积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为________ 。
 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
名校
2 . 乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的相关反应如下。
反应1: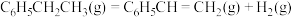
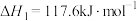
反应2:

反应3:
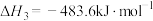
(1)反应4:
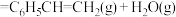

___________  。
。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是___________ 。
(3)向乙苯脱氢反应体系中加入 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为___________ 。 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。___________ ,反应一段时间后,催化剂活性有所下降,原因可能有反应过程产生的积碳覆盖在活性中心表面和___________ 。
②简述转化II的作用___________ 。
反应1:
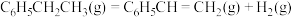
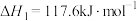
反应2:


反应3:

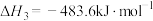
(1)反应4:

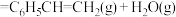

 。
。(2)较低温度下,向乙苯脱氢的反应体系中加入少量
 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是(3)向乙苯脱氢反应体系中加入
 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为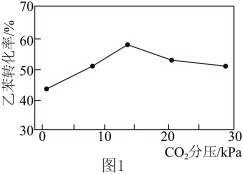
 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。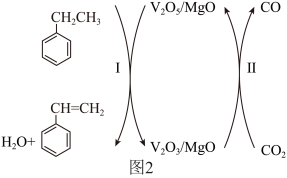
②简述转化II的作用
您最近一年使用:0次
3 . 二氯异氰尿酸钠(CNO)3Cl2Na)为白色固体,难溶于冷水, 是一种高效、安全的氧化性消毒剂。实验室用如图所示装置制备(夹持装置已略去)。回答下列问题:

已知:实验原理为:2NaClO + (CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,该反应为放热反应。
(1)仪器a中侧管的作用为_______ ,装置A中的药品不可以选择_______ 。
A. KMnO4 B. MnO2 C. K2Cr2O7 D. KClO
(2)装置B的作用是除去氯气中的HCl, 用平衡原理解释30%硫酸的作用_______ 。
(3)当从装置C中观察到_______ 时, 加入(CNO)3H3溶液。实验过程中C的温度必须保持在 17~20℃, pH控制在6.5~8.5, 若温度过高, pH值过低, 会生成NCl3,为避免生成NCl3,可采取的最佳改进措施为_______ 。
(4)二氯异氰尿酸钠缓慢水解可产生HClO 消毒灭菌。通过下列实验检测样品的有效氯含量: 准确称取 1.4200g样品, 用容量瓶配成250.0mL 溶液; 取 25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用 -1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点, 消耗 Na2S2O3溶液20.00mL。[已知
-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点, 消耗 Na2S2O3溶液20.00mL。[已知  该样品的有效氯=
该样品的有效氯= ]
]
①请算出该样品的有效氯_______ (写出计算过程)
②下列操作会导致样品的有效氯测定值偏高的是_______ 填序号)。
A. 盛装 Na2S2O3标准溶液的滴定管未润洗
B. 滴定管在滴定前无气泡,滴定后有气泡
C. 碘量瓶中加入的稀硫酸偏少

已知:实验原理为:2NaClO + (CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,该反应为放热反应。
(1)仪器a中侧管的作用为
A. KMnO4 B. MnO2 C. K2Cr2O7 D. KClO
(2)装置B的作用是除去氯气中的HCl, 用平衡原理解释30%硫酸的作用
(3)当从装置C中观察到
(4)二氯异氰尿酸钠缓慢水解可产生HClO 消毒灭菌。通过下列实验检测样品的有效氯含量: 准确称取 1.4200g样品, 用容量瓶配成250.0mL 溶液; 取 25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
 -1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点, 消耗 Na2S2O3溶液20.00mL。[已知
-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点, 消耗 Na2S2O3溶液20.00mL。[已知  该样品的有效氯=
该样品的有效氯= ]
]①请算出该样品的有效氯
②下列操作会导致样品的有效氯测定值偏高的是
A. 盛装 Na2S2O3标准溶液的滴定管未润洗
B. 滴定管在滴定前无气泡,滴定后有气泡
C. 碘量瓶中加入的稀硫酸偏少
您最近一年使用:0次
2023-10-20更新
|
410次组卷
|
3卷引用:江苏省淮安市5校2023-2024学年高三上学期10月份联考化学试题
江苏省淮安市5校2023-2024学年高三上学期10月份联考化学试题贵州省黔东南州从江县2023-2024学年高三上学期期中检测化学试题(已下线)题型二 实验中常考滴定计算-备战2024年高考化学答题技巧与模板构建
4 . 已知: (1) 血红蛋白可与 O2结合,血红蛋白更易与CO配位,血红蛋白与O2配位示意如图所示。 (2) 血红蛋白(Hb)与O2 、CO结合的反应可表示为
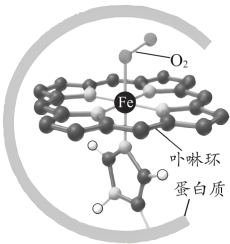
①Hb+O2⇌Hb(O2) K1;
②Hb+CO⇌Hb(CO) K2。
下列说法不正确的是

①Hb+O2⇌Hb(O2) K1;
②Hb+CO⇌Hb(CO) K2。
下列说法不正确的是
| A.相同温度下, K1>K2 |
| B.反应①②的ΔH均小于0 |
| C.CO中的C原子提供孤电子对与Fe2⁺配位 |
| D.用高压氧舱治疗CO中毒时,平衡②逆向移动 |
您最近一年使用:0次
5 . 液氨是一种很好的溶剂,液氨可以微弱的电离产生 和
和 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成 NH2OH(羟胺)。在有
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成 NH2OH(羟胺)。在有 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成 N2、NO、NO2、N2O4(无色)、HNO3等。对于反应2NO2(g)
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成 N2、NO、NO2、N2O4(无色)、HNO3等。对于反应2NO2(g) N2O4(g),下列说法正确的是
N2O4(g),下列说法正确的是
 和
和 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成 NH2OH(羟胺)。在有
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成 NH2OH(羟胺)。在有 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成 N2、NO、NO2、N2O4(无色)、HNO3等。对于反应2NO2(g)
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成 N2、NO、NO2、N2O4(无色)、HNO3等。对于反应2NO2(g) N2O4(g),下列说法正确的是
N2O4(g),下列说法正确的是A.该反应的 H>0 H>0  S<0 S<0 |
B.该反应的平衡常数表达式为  |
C.升高温度, 该反应的  (正)增大, (正)增大,  (逆)减小 (逆)减小 |
| D.将容器体积压缩为原来一半,气体颜色比压缩前深 |
您最近一年使用:0次
2023-10-20更新
|
323次组卷
|
5卷引用:江苏省淮安市5校2023-2024学年高三上学期10月份联考化学试题
名校
6 . 工业合成氨的反应为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是| A.使用高效催化剂可减小ΔH |
| B.适当降温或加压,反应的平衡常数都增大 |
| C.及时将体系中的NH3液化分离有利于平衡正向移动 |
D.用E表示键能,则: |
您最近一年使用:0次
2023-09-11更新
|
211次组卷
|
2卷引用:江苏省郑梁梅高级中学2022-2023学年高二下学期4月月考化学试题
解题方法
7 . 将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) H2(g)+I2(g) ΔH<0。
H2(g)+I2(g) ΔH<0。
(1)该反应平衡常数的表达式为K=_______ 。
(2)当反应达到平衡时,c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为_______ ,HI的分解率为_______ 。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0,则该时刻,反应向_______ (填“正向”或“逆向”,下同)进行,若升高温度,反应向_______ 进行。
 H2(g)+I2(g) ΔH<0。
H2(g)+I2(g) ΔH<0。(1)该反应平衡常数的表达式为K=
(2)当反应达到平衡时,c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0,则该时刻,反应向
您最近一年使用:0次
名校
8 . 2SO2(g)+O2(g)⇌2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为:V2O5+SO2=2VO2+SO3(快),4VO2+O2=2V2O5(慢)。下列说法中正确的是
| A.反应速率主要取决于V2O5的质量 | B.VO2是该反应的催化剂 |
| C.逆反应的活化能大于198 kJ·mol-1 | D.增大SO2的浓度可显著提高反应速率 |
您最近一年使用:0次
2022-12-05更新
|
204次组卷
|
15卷引用:江苏省淮安市涟水县第一中学2022-2023学年高二上学期第二次阶段检测化学试题
江苏省淮安市涟水县第一中学2022-2023学年高二上学期第二次阶段检测化学试题福建省三明市第一中学2021届高三上学期第一次月考化学试题吉林省延边第二中学2021-2022学年高二上学期第一次阶段检测化学试题河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题湖南省邵阳邵东市第一中学2021-2022学年高二上学期第一次月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题贵州省铜仁市第二中学2022-2023学年高三上学期第二次月考化学试题福建省厦门市2018届高三上学期期末质检化学试题辽宁省大石桥2018届高三上学期期末质检化学试题河南省中原名校(即豫南九校)2017-2018学年高二下学期第一次联考化学试题2020届高三化学二轮冲刺新题专练——影响化学反应速率的因素(提升练)(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)广东省潮州市2020-2021学年高三上学期期末考试化学试题福建省南靖县第一中学、兰水中学2022-2023学年高二上学期期中联考化学试题
9 . 回答下列问题
(1)在一定条件下反应H2(g)+I2(g)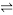 2HI(g) ΔH<0,在一密闭体系中达到化学平衡。在448 ℃时,该反应的化学平衡常数为49。
2HI(g) ΔH<0,在一密闭体系中达到化学平衡。在448 ℃时,该反应的化学平衡常数为49。
①下列说法中能说明该反应已达平衡状态的是_______ (填字母)。
A.压强不再改变 B.速率之比 v(H2)∶v(I2)∶v(HI)=1∶1∶2
C.混合气体的颜色不再改变 D.混合气体的密度不再改变
② 只改变下列条件,该化学平衡如何移动?a向正反应方向移动;b向逆反应方向移动;c不移动。升高温度_______ (填字母序号,下同);缩小容器的体积 _______ ;保持体积不变,通入氢气_______ ;保持压强不变,通入氩气_______ 。
(2)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:_______ ;每生成0.5mol乙醇,理论消耗铅蓄电池中_______ mol硫酸。

(3)据文献报道, CO2可在碱性水溶液中电解生成CH4,写出生成CH4的电极反应式为:_______ 。
(4)在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)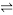 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
① 5 min时B的物质的量浓度为_______ 。
②5 min内用A表示的化学反应速率v(A)为_______ 。
③化学方程式中n为_______ 。
(1)在一定条件下反应H2(g)+I2(g)
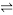 2HI(g) ΔH<0,在一密闭体系中达到化学平衡。在448 ℃时,该反应的化学平衡常数为49。
2HI(g) ΔH<0,在一密闭体系中达到化学平衡。在448 ℃时,该反应的化学平衡常数为49。①下列说法中能说明该反应已达平衡状态的是
A.压强不再改变 B.速率之比 v(H2)∶v(I2)∶v(HI)=1∶1∶2
C.混合气体的颜色不再改变 D.混合气体的密度不再改变
② 只改变下列条件,该化学平衡如何移动?a向正反应方向移动;b向逆反应方向移动;c不移动。升高温度
(2)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:

(3)据文献报道, CO2可在碱性水溶液中电解生成CH4,写出生成CH4的电极反应式为:
(4)在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)
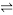 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:① 5 min时B的物质的量浓度为
②5 min内用A表示的化学反应速率v(A)为
③化学方程式中n为
您最近一年使用:0次
名校
10 . 可逆反应A(g)+3B(g) 2C(g) △H<0。有甲、乙两个容积相等且不变的真空密封容器,向甲容器中充入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中充入2molC,达到平衡时吸收的热量为Q2kJ,已知Q1=3Q2,下列叙述正确的是
2C(g) △H<0。有甲、乙两个容积相等且不变的真空密封容器,向甲容器中充入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中充入2molC,达到平衡时吸收的热量为Q2kJ,已知Q1=3Q2,下列叙述正确的是
 2C(g) △H<0。有甲、乙两个容积相等且不变的真空密封容器,向甲容器中充入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中充入2molC,达到平衡时吸收的热量为Q2kJ,已知Q1=3Q2,下列叙述正确的是
2C(g) △H<0。有甲、乙两个容积相等且不变的真空密封容器,向甲容器中充入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中充入2molC,达到平衡时吸收的热量为Q2kJ,已知Q1=3Q2,下列叙述正确的是| A.平衡时,甲、乙中C的体积分数为甲>乙 |
| B.甲中的A的转化率为75% |
| C.达到平衡后,再向乙中加入0.25molA、0.75molB和1.5molC ,平衡向生成A的方向移动 |
D.乙中反应的热化学方程式为2C(g) A(g)+3B(g) △H= + Q2kJ•mol-1 A(g)+3B(g) △H= + Q2kJ•mol-1 |
您最近一年使用:0次



