名校
解题方法
1 . 中国科学院大学以Bi为电极材料,利用电化学催化还原法制备HCOOH。用计算机模拟CO2在电极材料表面发生还原反应的历程如图(*表示微粒与Bi的接触位点):

(1)HCOOH是_______ (填“阴极”或“阳极”)产物,若在该电极消耗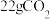 ,则转移电子物质的量为
,则转移电子物质的量为_______ mol。
(2)依据反应历程图中数据,你认为电催化还原 生成HCOOH的选择性
生成HCOOH的选择性_______ (填“高于”或“低于”)生成CO的选择性,原因是_______ 。

某温度下,在密封石英管内完全充满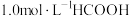 水溶液,使HCOOH分解,分解产物均完全溶于水。分解反应:反应Ⅰ.
水溶液,使HCOOH分解,分解产物均完全溶于水。分解反应:反应Ⅰ.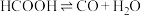 ,反应Ⅱ.
,反应Ⅱ. ,反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
,反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。

(3) 时刻测得CO、CO2的浓度分别为
时刻测得CO、CO2的浓度分别为 、
、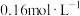 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为 。反应Ⅰ的平衡常数为
。反应Ⅰ的平衡常数为_______ 。②图上CO的浓度先增大后减小的原因是_______ 。
(4)实验测得: ,
, ,
, 、
、 为速率常数。该条件下
为速率常数。该条件下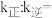
_______ 。

(1)HCOOH是
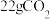 ,则转移电子物质的量为
,则转移电子物质的量为(2)依据反应历程图中数据,你认为电催化还原
 生成HCOOH的选择性
生成HCOOH的选择性
某温度下,在密封石英管内完全充满
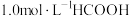 水溶液,使HCOOH分解,分解产物均完全溶于水。分解反应:反应Ⅰ.
水溶液,使HCOOH分解,分解产物均完全溶于水。分解反应:反应Ⅰ.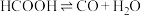 ,反应Ⅱ.
,反应Ⅱ. ,反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
,反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
(3)
 时刻测得CO、CO2的浓度分别为
时刻测得CO、CO2的浓度分别为 、
、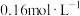 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为 。反应Ⅰ的平衡常数为
。反应Ⅰ的平衡常数为(4)实验测得:
 ,
, ,
, 、
、 为速率常数。该条件下
为速率常数。该条件下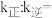
您最近一年使用:0次
名校
2 . 我国科学家成功利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应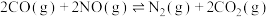 平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
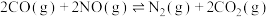 平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
平衡时,测得c(N2)=0.2mol/L,下列说法正确的是| A.升高温度,正、逆反应速率以相同倍数增大 |
| B.加入催化剂使正反应速率加快,逆反应活化能增大 |
C.若往容器中再通入1molNO和1molCO2,则此时 |
D.若往容器中再通入2molCO和1molN2,则此时 |
您最近一年使用:0次
2024-01-23更新
|
745次组卷
|
5卷引用:江苏省扬州中学2023-2024学年高二下学期3月考试化学试题
江苏省扬州中学2023-2024学年高二下学期3月考试化学试题2024年1月江西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题11-14(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
3 . 肼(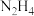 )是一种含氢量高的燃料。向恒容密闭容器内加入
)是一种含氢量高的燃料。向恒容密闭容器内加入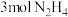 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:
I.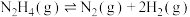
Ⅱ.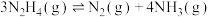
不同温度下达到平衡时,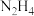 均几乎完全分解,分解产物的物质的量如图。下列说法正确的是
均几乎完全分解,分解产物的物质的量如图。下列说法正确的是
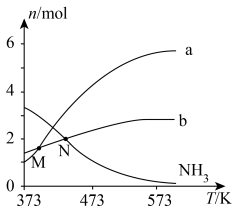
A.曲线a对应的物质是 |
| B.低于M点对应温度时,以反应Ⅰ为主 |
C.体系中还存在 |
D.N点时,体系内 为3:4 为3:4 |
您最近一年使用:0次
2024-01-22更新
|
836次组卷
|
6卷引用:江苏省扬州中学2023-2024学年高二下学期3月考试化学试题
江苏省扬州中学2023-2024学年高二下学期3月考试化学试题2024年1月广西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”广西卷真题完全解读与考后提升(已下线)选择题11-14(已下线)热点13 化学反应速率与化学平衡(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
4 . 在913K、100kPa下,以水蒸气作稀释气, 作催化剂,乙苯脱氢生成苯乙烯时会发生反应:
作催化剂,乙苯脱氢生成苯乙烯时会发生反应:
反应Ⅰ: (主反应)
(主反应)
反应Ⅱ: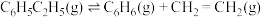 (副反应)
(副反应)
反应Ⅲ: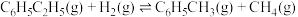 (副反应)
(副反应)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示。下列说法正确的是
)随乙苯转化率的变化曲线如图所示。下列说法正确的是
 作催化剂,乙苯脱氢生成苯乙烯时会发生反应:
作催化剂,乙苯脱氢生成苯乙烯时会发生反应:反应Ⅰ:
 (主反应)
(主反应)反应Ⅱ:
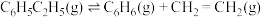 (副反应)
(副反应)反应Ⅲ:
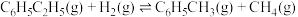 (副反应)
(副反应)以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示。下列说法正确的是
)随乙苯转化率的变化曲线如图所示。下列说法正确的是
| A.曲线b代表的产物是苯 |
B.加入 可改变乙苯的平衡转化率 可改变乙苯的平衡转化率 |
| C.曲线a下降是由于反应Ⅰ的平衡逆向移动 |
| D.增加水蒸气的充入量,可提高乙苯的平衡转化率 |
您最近一年使用:0次
名校
解题方法
5 . 回收锑冶炼厂的砷碱渣中砷的过程可表示为:

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是_______ 。
(2)“沉砷”过程发生反应: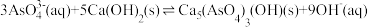 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为_______ (用含a、b的表达式作答)。
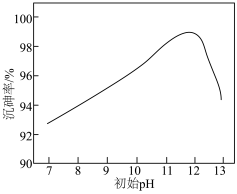
(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是_______ 。
(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为_______ 。
② Na2S须过量,原因是_______ 。
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为_______ 。
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为_______ 。

已知:①砷碱渣主要含Na3AsO4、Na[Sb(OH)6]、SiO2即少量砷的硫化物;
②25 ℃ Ka1(H3AsO4)=6×10-3、Ka[HSb(OH)6]=2.8×10-3、Ksp[Ca(OH)2]=a、Ksp[Ca5(AsO4)3(OH)]=b。
(1)“水浸”后所得溶液呈碱性,其原因可能是
(2)“沉砷”过程发生反应:
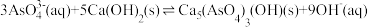 ,该反应的平衡常数K可以表示为
,该反应的平衡常数K可以表示为(3)在常温下,调节“过滤1”所得滤液的pH,沉砷率与滤液初始pH的关系如图所示。pH<12时,沉砷率随pH增大而增大的原因可能是

(4)已知:硫代锑酸钠(Na3SbS4)易溶于水,在碱性溶液中较稳定。
①“过滤2”所得滤液中加入Na2S可以将Na[Sb(OH)6]转化为Na3SbS4,该反应的离子方程式为
② Na2S须过量,原因是
(5)“还原”步骤中,Ca5(AsO4)3(OH)先分解为Ca3(AsO4)2, Ca3(AsO4)2与C反应生成CO和砷蒸气,其物质的量之比为10:1。蒸气中砷分子为正四面体结构,其化学式为
(6)砷的硫化物在自然界中主要为As4S6、As4S4等。已知As4S6中所有原子均为8电子稳定结构,且不存在四元环结构,不含As-As键和S-S键。其结构式可表示为
您最近一年使用:0次
名校
6 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的 ,其部分实验过程如下:
,其部分实验过程如下:
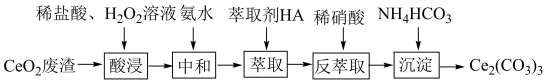
(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为___________
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。
①得到含 量较少的
量较少的 的加料方式为
的加料方式为___________ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
② 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:___________
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是___________ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有___________ 。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的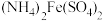 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为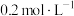 ],加氧化剂将
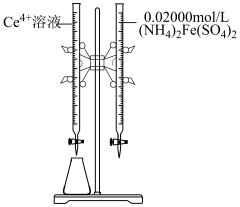
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将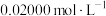
 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③___________
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成 沉淀,同时放出
沉淀,同时放出 ,该沉淀中
,该沉淀中 含量与加料方式有关。
含量与加料方式有关。①得到含
 量较少的
量较少的 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中②
 溶液与
溶液与 溶液反应的离子方程式:
溶液反应的离子方程式:(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的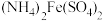 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取25.00 mL
。请补充完整实验方案:①准确量取25.00 mL  溶液[
溶液[ 约为
约为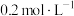 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;②按规定操作分别将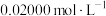
 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近一年使用:0次
名校
解题方法
7 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为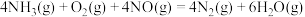

(1)催化剂___________ 改变ΔH(填“能”或“不能”)
(2)催化剂的制备。将预先制备的一定量的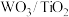 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为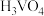 沉淀的离子方程式为
沉淀的离子方程式为___________ ;
(3)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
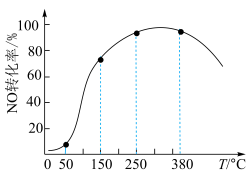
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:___________
(4)废催化剂的回收。回收 催化剂并制备
催化剂并制备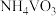 的过程可表示为
的过程可表示为

①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
②向pH=8的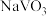 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知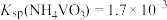 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
(5)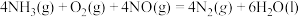 ΔH
ΔH___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为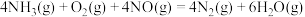

(1)催化剂
(2)催化剂的制备。将预先制备的一定量的
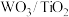 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为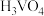 沉淀的离子方程式为
沉淀的离子方程式为(3)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:
(4)废催化剂的回收。回收
 催化剂并制备
催化剂并制备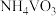 的过程可表示为
的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
②向pH=8的
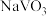 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知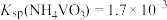 ,加过量
,加过量 溶液的目的是
溶液的目的是(5)
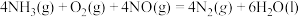 ΔH
ΔH (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近一年使用:0次
名校
8 . 对于反应
 。下列说法正确的是
。下列说法正确的是

 。下列说法正确的是
。下列说法正确的是A.只要氧气过量,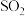 就可以实现转化率100% 就可以实现转化率100% |
| B.其他条件不变,升高体系的温度,该反应的平衡常数K增大 |
C.保持其他条件不变,增大 浓度能提高 浓度能提高 的反应速率和转化率 的反应速率和转化率 |
| D.使用催化剂能改变反应途径,不能改变反应的活化能 |
您最近一年使用:0次
9 . 由 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
反应Ⅰ:
 kJ·mol
kJ·mol
反应Ⅱ:
 kJ·mol
kJ·mol
反应Ⅲ: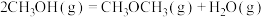
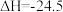 kJ·mol
kJ·mol
在其他条件相同的情况下,按 (总量一定)投料于恒容密闭容器中进行反应,
(总量一定)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择性[甲醇的选择性:
的平衡转化率和甲醇的选择性[甲醇的选择性: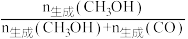 ]随温度的变化趋势如图所示:
]随温度的变化趋势如图所示:
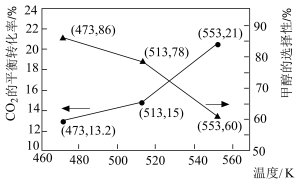
下列说法不正确 的是
 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:反应Ⅰ:

 kJ·mol
kJ·mol
反应Ⅱ:

 kJ·mol
kJ·mol
反应Ⅲ:
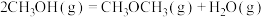
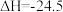 kJ·mol
kJ·mol
在其他条件相同的情况下,按
 (总量一定)投料于恒容密闭容器中进行反应,
(总量一定)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择性[甲醇的选择性:
的平衡转化率和甲醇的选择性[甲醇的选择性: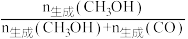 ]随温度的变化趋势如图所示:
]随温度的变化趋势如图所示:
下列说法
A.一定温度下,增大 与 与 的物质的量之比,可以提高 的物质的量之比,可以提高 的平衡转化率 的平衡转化率 |
| B.根据图中数据,温度选择553K,达到平衡时,反应体系内甲醇的产量最低 |
C.由 和CO制备二甲醚的热化学方程式: 和CO制备二甲醚的热化学方程式: 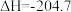 kJ·mol kJ·mol |
D.473~513K范围内,温度升高,平衡时的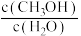 逐渐增大 逐渐增大 |
您最近一年使用:0次
解题方法
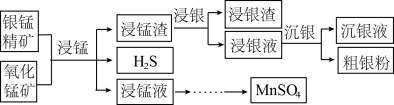
10 . 以银锰精矿(主要含 、
、 、
、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下, 的氧化性强于
的氧化性强于 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,发生了反应
的形式残留于浸锰渣中。“浸锰”过程中,发生了反应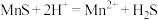 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
_______ 。
(2)“浸银”时,使用过量 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①“浸银”反应的离子方程式为_______ 。
②结合平衡移动原理,解释浸出剂中 、
、 的作用是
的作用是_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①“沉银”过程中主要反应的离子方程式为_______ 。
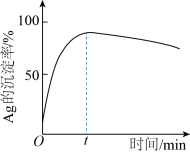
②一定温度下, 的沉淀率随反应时间的变化如图所示。解释t分钟后
的沉淀率随反应时间的变化如图所示。解释t分钟后 的沉淀率逐渐减小的原因是
的沉淀率逐渐减小的原因是_______ 。
(4)“浸锰”过程中产生的 可用于“浸银”,生产中需要测定
可用于“浸银”,生产中需要测定 的浓度来确定其用量。测定方法:准确量取20.00
的浓度来确定其用量。测定方法:准确量取20.00 浸取液置于250
浸取液置于250 锥形瓶中,加入适量稀硫酸,滴加稍过量的
锥形瓶中,加入适量稀硫酸,滴加稍过量的 溶液(
溶液( 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的 。用
。用
 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液12.00
溶液12.00 。计算浸取液中
。计算浸取液中 的浓度
的浓度_______ (写出计算过程)。
 、
、 、
、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下。
)为原料联合提取银和锰的一种流程示意图如下。
已知:酸性条件下,
 的氧化性强于
的氧化性强于 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。“浸锰”过程中,发生了反应
的形式残留于浸锰渣中。“浸锰”过程中,发生了反应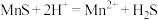 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
(2)“浸银”时,使用过量
 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①“浸银”反应的离子方程式为
②结合平衡移动原理,解释浸出剂中
 、
、 的作用是
的作用是(3)“沉银”过程中需要过量的铁粉作为还原剂。
①“沉银”过程中主要反应的离子方程式为
②一定温度下,
 的沉淀率随反应时间的变化如图所示。解释t分钟后
的沉淀率随反应时间的变化如图所示。解释t分钟后 的沉淀率逐渐减小的原因是
的沉淀率逐渐减小的原因是
(4)“浸锰”过程中产生的
 可用于“浸银”,生产中需要测定
可用于“浸银”,生产中需要测定 的浓度来确定其用量。测定方法:准确量取20.00
的浓度来确定其用量。测定方法:准确量取20.00 浸取液置于250
浸取液置于250 锥形瓶中,加入适量稀硫酸,滴加稍过量的
锥形瓶中,加入适量稀硫酸,滴加稍过量的 溶液(
溶液( 将
将 还原为
还原为 ),充分反应后,除去过量的
),充分反应后,除去过量的 。用
。用
 溶液滴定至终点(滴定过程中
溶液滴定至终点(滴定过程中 与
与 反应生成
反应生成 和
和 ),消耗
),消耗 溶液12.00
溶液12.00 。计算浸取液中
。计算浸取液中 的浓度
的浓度
您最近一年使用:0次



