1 .  是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。
已知:当一个反应的K大于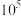 时,可以认为该反应进行完全
时,可以认为该反应进行完全
Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到 、
、 、
、 、
、 沉淀。
沉淀。
①调节pH过程中, 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②实验过程中若要使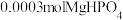 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至___________ 。(设溶液的体积为1L)。
Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①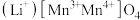 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素___________ (填元素符号)

②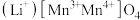 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:
第一步酸性条件下脱锂,获得(□)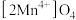 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: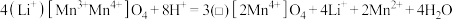
第二步取出(口)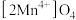 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为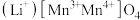 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式___________ 。
③该吸附剂的另一优点是选择性高,吸附 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是___________ 。
(3)离子交换吸附
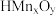 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的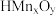 吸附相同体积溶液中的
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于___________ 。请确定溶液起始吸附最佳的pH并说明理由___________ 。
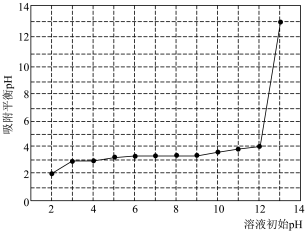
 是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。已知:当一个反应的K大于
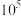 时,可以认为该反应进行完全
时,可以认为该反应进行完全Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到
 、
、 、
、 、
、 沉淀。
沉淀。①调节pH过程中,
 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为②实验过程中若要使
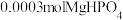 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①
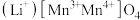 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
②
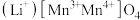 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:第一步酸性条件下脱锂,获得(□)
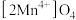 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: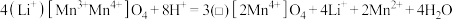
第二步取出(口)
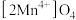 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为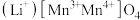 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式③该吸附剂的另一优点是选择性高,吸附
 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是(3)离子交换吸附
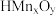 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的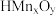 吸附相同体积溶液中的
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于
您最近一年使用:0次
名校
2 . 对于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A.其他条件不变,升高温度,颜色加深,则该反应的 |
| B.将反应器容积压缩为原来的一半,气体颜色比压缩前深 |
| C.升高温度,该反应的正反应速率减小,逆反应速率增大 |
D.其它条件不变,向平衡后的容器中再加入少量 ,达新平衡后 ,达新平衡后 的值减小 的值减小 |
您最近一年使用:0次
2024-03-04更新
|
175次组卷
|
2卷引用:江苏省镇江市丹阳高级中学2023-2024学年高三下学期3月月考化学试题
名校
3 . 以方铅矿(主要成分 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为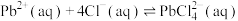
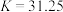
②
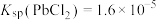
(1) 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为___________ ;“协同浸取”时加入 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是___________ 。
(2)“沉降分铅”的目的是将滤液中的 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数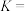
___________ 。
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是________ 。
(4)制备 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中,___________ ,真空40干燥得产品 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为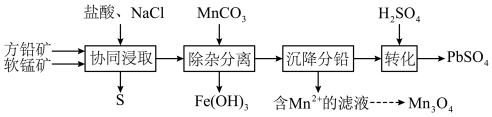
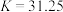
②

(1)
 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是(2)“沉降分铅”的目的是将滤液中的
 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数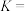
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与
 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是(4)制备
 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中, 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)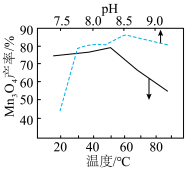
您最近一年使用:0次
2024-03-01更新
|
688次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高三下学期4月月考化学试题
4 . 硝基苯是一种具有稳定化学性质、高毒性、难生物降解的污染物。工业上采用吸附、还原、氧化等方法可有效降解废水中的硝基苯。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图1所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是___________ (请从平衡移动角度解释)。___________ 。
(3)研究发现,H2O2在一定条件下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。H2O2、KMnO4也可以与硝基苯直接发生氧化降解反应。___________ (填化学式),该氧化剂的效果优于其他两种的可能原因是___________ 。
②通过电激发也可以产生HO·,可能的机理如图4,产生过程可描述为___________ 。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图1所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是

①酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯(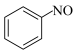 ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
(3)研究发现,H2O2在一定条件下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。H2O2、KMnO4也可以与硝基苯直接发生氧化降解反应。
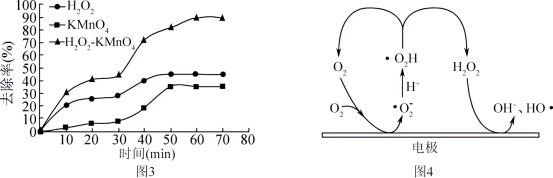
②通过电激发也可以产生HO·,可能的机理如图4,产生过程可描述为
您最近一年使用:0次
解题方法
5 . 向一个固定体积的密闭容器充入2molA和1molB,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
(1)用A表示2分钟内平均反应速率为_______ 。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为_______ (填“吸热”或“放热”)反应。
(3)增大B的转化率,可采取的措施是_______ (用序号填空)
① 加入A ② 升高温度 ③ 加压 ④ 再加入1.6molA+0.8molB ⑤ 将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是_______ ;若升高温度时,请将反应速率变化情况画在c-d处_______ 。

 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。(1)用A表示2分钟内平均反应速率为
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(3)增大B的转化率,可采取的措施是
① 加入A ② 升高温度 ③ 加压 ④ 再加入1.6molA+0.8molB ⑤ 将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是

您最近一年使用:0次
名校
6 . 有效去除大气和水体中的氮氧化物是环境保护的重要课题。
(1)某学者使用 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。
①通入 的目的是
的目的是________ 。
②若不通入 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是_____ 。
(2)含氯化合物可将废气中的 转化成
转化成 脱除。
脱除。
①提高废气中 脱除率的可行措施有
脱除率的可行措施有______ (填字母)。
A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL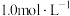
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是______ 。
③按一定流速将含 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是______ 。
(3)有人研究了用纳米零价铁去除水体中 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是_______ 。

(1)某学者使用
 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。①通入
 的目的是
的目的是②若不通入
 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是(2)含氯化合物可将废气中的
 转化成
转化成 脱除。
脱除。①提高废气中
 脱除率的可行措施有
脱除率的可行措施有A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL
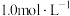
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是③按一定流速将含
 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是(3)有人研究了用纳米零价铁去除水体中
 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是
您最近一年使用:0次
2024-02-16更新
|
141次组卷
|
2卷引用:11.2024年苏州木渎高级中学高一3月月考
7 . 2023年9月23日,第19届亚运会在杭州开幕.回收的 与
与 催化反应合成的绿色甲醇
催化反应合成的绿色甲醇 作为主火炬塔燃料,彰显了“绿色亚运”的主题.一定温度下,在固定容积的密闭容器中发生反应
作为主火炬塔燃料,彰显了“绿色亚运”的主题.一定温度下,在固定容积的密闭容器中发生反应 .下列说法正确的是
.下列说法正确的是
 与
与 催化反应合成的绿色甲醇
催化反应合成的绿色甲醇 作为主火炬塔燃料,彰显了“绿色亚运”的主题.一定温度下,在固定容积的密闭容器中发生反应
作为主火炬塔燃料,彰显了“绿色亚运”的主题.一定温度下,在固定容积的密闭容器中发生反应 .下列说法正确的是
.下列说法正确的是| A.使用绿色甲醇作主火炬塔燃料实现了循环内碳的零排放 |
| B.反应后容器中气体压强增大 |
| C.反应后混合气体的密度减小 |
| D.反应后混合气体的平均摩尔质量减小 |
您最近一年使用:0次
2024-02-02更新
|
115次组卷
|
2卷引用:江苏省2023-2024学年高一下学期学期3月月考化学试题
名校
8 .  还原
还原 制
制 的反应体系中,主要发生反应的热化学方程式为
的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ

反应Ⅱ

在恒容密闭容器中,起始投入一定物质的量的 和
和 发生反应,平衡时
发生反应,平衡时 的转化率、产物
的转化率、产物 或CO其中之一的选择性[
或CO其中之一的选择性[ ]随温度变化如下图所示。下列说法正确的是
]随温度变化如下图所示。下列说法正确的是

 还原
还原 制
制 的反应体系中,主要发生反应的热化学方程式为
的反应体系中,主要发生反应的热化学方程式为反应Ⅰ


反应Ⅱ


在恒容密闭容器中,起始投入一定物质的量的
 和
和 发生反应,平衡时
发生反应,平衡时 的转化率、产物
的转化率、产物 或CO其中之一的选择性[
或CO其中之一的选择性[ ]随温度变化如下图所示。下列说法正确的是
]随温度变化如下图所示。下列说法正确的是
| A.图中曲线a表示CO的选择性 |
B.200~600℃时,温度越高,平衡时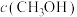 的浓度越小 的浓度越小 |
C.研究和使用在低温区高效的催化剂可提高制取 的产率 的产率 |
| D.高于600℃,反应Ⅱ的速率加快,反应Ⅰ的速率减慢 |
您最近一年使用:0次
名校
9 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 将两只装有NO2的玻璃球分别置于冷水和热水中 | 温度对化学平衡产生影响 |
| B | 向盛有淀粉、KI的溶液中滴加HNO3酸化的 溶液,振荡 溶液,振荡 | 比较Fe3+和I2的氧化性 |
| C | 用pH计分别测量等体积HCOOH和CH3COOH溶液的pH | 推电子基团对羧基酸性影响的比较 |
| D | 向溴水中滴加少量乙醇,振荡 | 比较Br2在水中和乙醇中溶解度的大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 脱除汽车尾气中的NO和CO包括以下两个反应:
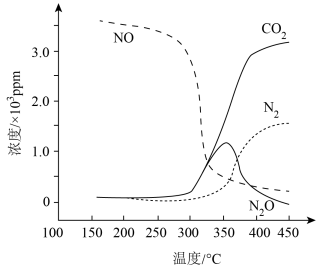
Ⅰ.
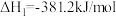
Ⅱ.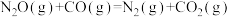
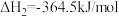
将恒定组成的NO和CO混合气通入不同温度的反应器,相同时间内检测物质浓度,结果如题13图所示。下列说法正确的是
Ⅰ.

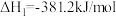
Ⅱ.
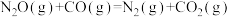
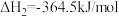
将恒定组成的NO和CO混合气通入不同温度的反应器,相同时间内检测物质浓度,结果如题13图所示。下列说法正确的是

A.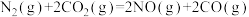 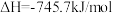 |
| B.使用合适催化剂,能提高NO的平衡转化率 |
| C.其他条件不变,增大体系的压强,NO的平衡转化率增大 |
| D.350℃~420℃范围内,温度升高,反应Ⅰ速率增大的幅度大于反应Ⅱ速率增大的幅度 |
您最近一年使用:0次



