1 . 使用合适的催化剂进行乙酸直接加氢可制备乙醇,反应原理如下:
主反应:

副反应:
 (热效应小可忽略)
(热效应小可忽略)
在密闭容器中控制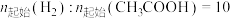 。
。 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为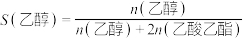 。下列说法正确的是
。下列说法正确的是
主反应:


副反应:

 (热效应小可忽略)
(热效应小可忽略)在密闭容器中控制
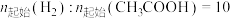 。
。 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为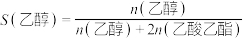 。下列说法正确的是
。下列说法正确的是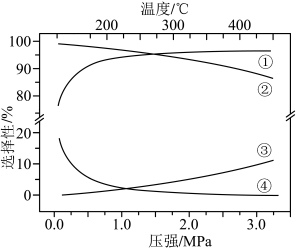
A.反应  |
| B.曲线②变化的原因是随温度升高,副反应正向进行的程度减小 |
| C.图中曲线③表示250℃,乙醇选择性随压强变化的曲线 |
D.300℃、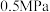 下,反应足够长时间,S(乙醇) 下,反应足够长时间,S(乙醇)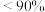 |
您最近一年使用:0次
2024-04-23更新
|
167次组卷
|
2卷引用:2024届江苏省新高考基地学校高三下学期第五次大联考化学试题
2 . 纳米级材料Cu2O有非常优良的催化性能。工业上在高温条件下用炭粉还原CuO制得: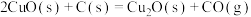
 。下列说法正确的是
。下列说法正确的是
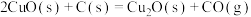
 。下列说法正确的是
。下列说法正确的是| A.该反应在任何温度下均可自发进行 |
| B.该反应的平衡常数K=c(CO) |
| C.其他条件相同,加入更多的炭粉,可以提高CuO的平衡转化率 |
| D.反应中生成22.4L,转移的电子数目为2×6.02×1023 |
您最近一年使用:0次
2024-04-23更新
|
110次组卷
|
2卷引用:2024届江苏省新高考基地学校高三下学期第五次大联考化学试题
3 . 回答下列问题。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。平衡时H2的转化率为
2NH3(g)∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。平衡时H2的转化率为___________ %。
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g)∆H<0,其化学平衡常数K与温度T的关系如表所示:请完成下列问题:
2NH3(g)∆H<0,其化学平衡常数K与温度T的关系如表所示:请完成下列问题:
①写出化学平衡常数K的表达式___________ 。
②试比较K1、K2的大小,K1___________ K2(填“>”、“<”或“=”);
③400℃时,当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正___________ v(N2)逆(填“>”、“<”或“=”)。
(3)平衡后,若提高H2的转化率,可以采取的措施有___________。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g)∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。平衡时H2的转化率为
2NH3(g)∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。平衡时H2的转化率为(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g)∆H<0,其化学平衡常数K与温度T的关系如表所示:请完成下列问题:
2NH3(g)∆H<0,其化学平衡常数K与温度T的关系如表所示:请完成下列问题:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②试比较K1、K2的大小,K1
③400℃时,当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正
(3)平衡后,若提高H2的转化率,可以采取的措施有___________。
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
您最近一年使用:0次
名校
解题方法
4 . 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。___________ 。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=___________ 。
(3)2min反应达到平衡时体系内的压强比起始时的压强___________ (填增大、减小或无变化);平衡时混合气体密度和起始时相比___________ (填增大、减小或无变化)。
(4)下列说法正确的是___________。

(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=
(3)2min反应达到平衡时体系内的压强比起始时的压强
(4)下列说法正确的是___________。
| A.使用催化剂不可以使化学平衡发生移动。 |
| B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢 |
| C.增大Y的浓度,正反应速率加快,逆反应速率减慢 |
| D.化学反应的限度是不可能改变的 |
您最近一年使用:0次
名校
5 . 已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
 N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
A.反应2NO2(g) N2O4(g)的正反应为吸热反应 N2O4(g)的正反应为吸热反应 |
| B.上述过程中,A烧瓶内正、逆反应速率均加快 |
| C.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
| D.上述过程中,A,B烧瓶内气体密度均保持不变 |
您最近一年使用:0次
名校
解题方法
6 . 反应 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A. 位于元素周期表 位于元素周期表 区 区 |
B.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
C.该反应的平衡常数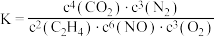 |
D.其他条件不变时,增大 , ,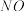 的平衡转化率下降 的平衡转化率下降 |
您最近一年使用:0次
7 . 下列说法或表示正确的是
A.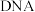 双螺旋结构中的两条多聚核苷酸链间通过共价键相互结合 双螺旋结构中的两条多聚核苷酸链间通过共价键相互结合 |
B. 要在光照和点燃条件下才反应,所以 要在光照和点燃条件下才反应,所以 , , |
C.已知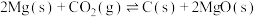 ,达平衡后,缩小容器体积, ,达平衡后,缩小容器体积, 浓度增大 浓度增大 |
D.将 的醋酸稀释为 的醋酸稀释为 的过程中, 的过程中, 减小 减小 |
您最近一年使用:0次
名校
8 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下: 的氧化性强于
的氧化性强于 ;II.
;II. 。
。
(1)“浸锰”过程中, 溶液可浸出矿石中
溶液可浸出矿石中 锰元素,同时去除
锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
① 晶胞如图所示,距离S
晶胞如图所示,距离S 最近的Fe2+的个数为
最近的Fe2+的个数为___________ 。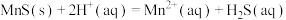 ,其平衡常数K与
,其平衡常数K与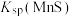 、
、 、
、 的代数关系式为
的代数关系式为
___________ 。
③去除 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为___________ 。
(2)“浸银”过程中,使用过量 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为2Fe3+ + Ag2S + 4Cl-
形式浸出,反应为2Fe3+ + Ag2S + 4Cl- 2Fe2+ + 2[AgCl2]-+ S。结合平衡移动原理,分析浸出剂中
2Fe2+ + 2[AgCl2]-+ S。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为___________ 。
(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是___________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是___________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下: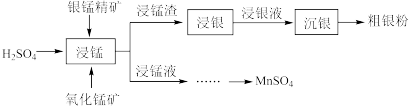
 的氧化性强于
的氧化性强于 ;II.
;II. 。
。(1)“浸锰”过程中,
 溶液可浸出矿石中
溶液可浸出矿石中 锰元素,同时去除
锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①
 晶胞如图所示,距离S
晶胞如图所示,距离S 最近的Fe2+的个数为
最近的Fe2+的个数为
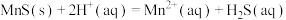 ,其平衡常数K与
,其平衡常数K与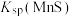 、
、 、
、 的代数关系式为
的代数关系式为
③去除
 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为(2)“浸银”过程中,使用过量
 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为2Fe3+ + Ag2S + 4Cl-
形式浸出,反应为2Fe3+ + Ag2S + 4Cl- 2Fe2+ + 2[AgCl2]-+ S。结合平衡移动原理,分析浸出剂中
2Fe2+ + 2[AgCl2]-+ S。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是

您最近一年使用:0次
名校
9 . 完成下列填空:
(1) 气态高能燃料乙硼烷
气态高能燃料乙硼烷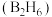 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
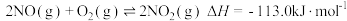 ①
①
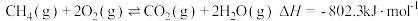 ②
②
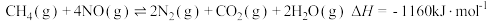 ③
③
则反应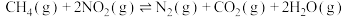 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷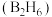 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: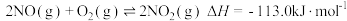 ①
①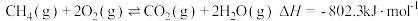 ②
②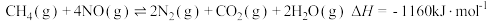 ③
③则反应
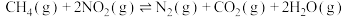 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)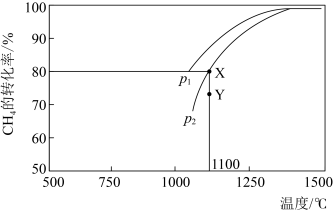
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是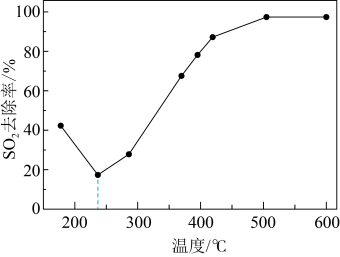
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是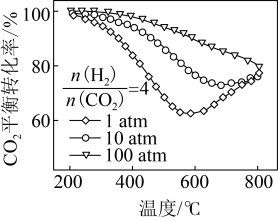
您最近一年使用:0次
10 . 在一个2L的密闭容器中投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如图所示:___________ 。
(2)8min时反应达平衡状态,下列能说明该反应已达到平衡状态的是___________(填序号)。
(3)升高温度,该反应的K值将___________ (填“增大”、“减小”或“不变”)。
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为___________ (填a、b、c或d)。
(5)若保持容积不变,在第12min时加入SO3(g),则平衡向___________ (填“正”或“逆”)反应方向移动,SO3的体积分数___________ (填“增大”或“减小”)。
 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如图所示:
(2)8min时反应达平衡状态,下列能说明该反应已达到平衡状态的是___________(填序号)。
| A.n(SO3)∶n(SO2)∶n(O2)=2∶2∶1 |
| B.容器内压强保持不变 |
| C.v(SO2)逆=2v(O2)正 |
| D.容器内密度保持不变 |
(3)升高温度,该反应的K值将
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为
(5)若保持容积不变,在第12min时加入SO3(g),则平衡向
您最近一年使用:0次



