使用合适的催化剂进行乙酸直接加氢可制备乙醇,反应原理如下:
主反应:

副反应:
 (热效应小可忽略)
(热效应小可忽略)
在密闭容器中控制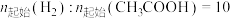 。
。 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为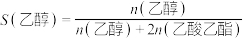 。下列说法正确的是
。下列说法正确的是
主反应:


副反应:

 (热效应小可忽略)
(热效应小可忽略)在密闭容器中控制
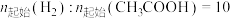 。
。 下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为
下平衡时S(乙醇)和S(乙酸乙酯)随温度的变化与250℃下平衡时S(乙醇)和S(乙酸乙酯)随压强的变化如图所示。乙醇的选择性可表示为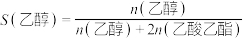 。下列说法正确的是
。下列说法正确的是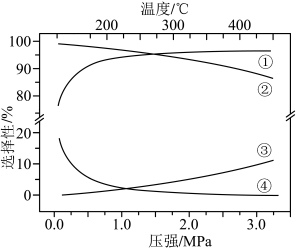
A.反应  |
| B.曲线②变化的原因是随温度升高,副反应正向进行的程度减小 |
| C.图中曲线③表示250℃,乙醇选择性随压强变化的曲线 |
D.300℃、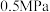 下,反应足够长时间,S(乙醇) 下,反应足够长时间,S(乙醇)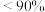 |
更新时间:2024-05-23 20:03:35
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=+247.4kJ·mol-1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应③:CH4(g)+ O2(g)⇌CO(g)+2H2(g) ΔH3= -35.6kJ·mol-1
O2(g)⇌CO(g)+2H2(g) ΔH3= -35.6kJ·mol-1
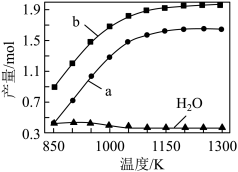
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,下列说法正确的是
反应①:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=+247.4kJ·mol-1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应③:CH4(g)+
 O2(g)⇌CO(g)+2H2(g) ΔH3= -35.6kJ·mol-1
O2(g)⇌CO(g)+2H2(g) ΔH3= -35.6kJ·mol-1一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,下列说法正确的是

| A.2CO(g)+O2(g)=2CO2(g) ΔH=-283kJ·mol-1 |
| B.图中曲线a和b分别代表产物CO和H2 |
| C.温度高于900K时,H2O的含量下降的原因之一是反应③向逆向进行 |
| D.升高温度和增加压强均能使CO的产量增加 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+ 5O2(g)→ 3CO2 (g)+ 4H2O(l) △H =-a kJ·mol-1
途径II:C3H8(g) → C3H6(g)+ H2(g) △H = +b kJ·mol-1
2C3H6(g)+ 9O2 (g)→ 6CO2 (g)+ 6H2O(l) △H = -c kJ·mol-1
2H2(g)+ O2 (g)=2H2O(l) △H = -d kJ·mol-1(a、b、c、d均为正值)
则有关a、b、c、d的关系正确的是
途径I:C3H8(g)+ 5O2(g)→ 3CO2 (g)+ 4H2O(l) △H =-a kJ·mol-1
途径II:C3H8(g) → C3H6(g)+ H2(g) △H = +b kJ·mol-1
2C3H6(g)+ 9O2 (g)→ 6CO2 (g)+ 6H2O(l) △H = -c kJ·mol-1
2H2(g)+ O2 (g)=2H2O(l) △H = -d kJ·mol-1(a、b、c、d均为正值)
则有关a、b、c、d的关系正确的是
| A.2b=c+d-2a | B.b=c+d-2a |
| C.2b=c-d-2a | D.b=c+d+2a |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】在体积均为1.0 L的恒容密闭容器中加入足量的相同的炭粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)  2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上),下列说法不正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上),下列说法不正确的是
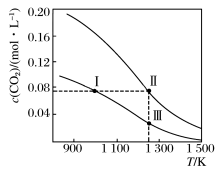
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上),下列说法不正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上),下列说法不正确的是
A.反应CO2(g)+C(s)  2CO(g)的ΔS>0,ΔH>0 2CO(g)的ΔS>0,ΔH>0 |
| B.体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ) |
| C.体系的总压强p总:p总 (状态Ⅱ) > 2p总(状态Ⅰ) |
| D.逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】甲醇脱氢法制HCOOCH3工艺过程涉及如下反应:
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g) ΔH1=+135.4 kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g) ΔH2=+106.0 kJ·mol-1
向容积为10 L的恒容密闭容器中通入1.0 mol CH3OH气体发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如下图所示。

(已知:HCOOCH3的选择性=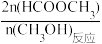 ×100%)
×100%)
下列说法正确的是
反应Ⅰ:2CH3OH(g)=HCOOCH3(g)+2H2(g) ΔH1=+135.4 kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g) ΔH2=+106.0 kJ·mol-1
向容积为10 L的恒容密闭容器中通入1.0 mol CH3OH气体发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如下图所示。

(已知:HCOOCH3的选择性=
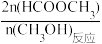 ×100%)
×100%) 下列说法正确的是
| A.2CO(g)+2H2(g)=HCOOCH3(g)的ΔH=+76.6 kJ·mol-1 |
| B.虚线代表的是CH3OH的转化率 |
| C.553K时,HCOOCH3的产量为 0.1mol |
| D.低于553K时,温度越高,生成的HCOOCH3越多。高于553K时,温度越高,生成的CO越多 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知:A(g)+2B(g) 3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
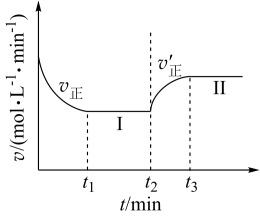
 3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
| A.容器内压强不变,表明反应达到平衡 |
| B.t2时改变的条件:向容器中加入B |
| C.平衡时A的浓度:c(II)>c(I) |
| D.平衡常数K:K(II)<K(I) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】NH3分解的热化学方程式为 .在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
.在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
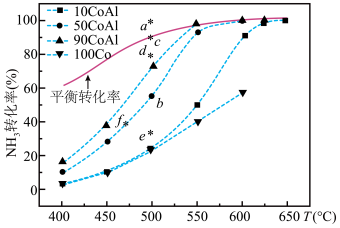
下列说法错误的是
 .在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
.在Co-Al催化剂体系中,压强P0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
下列说法错误的是
| A.活化能最小的催化剂是 90 Co-A1 |
| B.如果增大气体流速,则b点对应的点可能为e |
| C.温度为T时,向体积为1L的恒容容器中加入0.8 molNH3和0.1molH2,达到平衡时,NH3的转化率为75%,则平衡常数为K=7.5 |
| D.在两个体积均为VL的绝热密闭容器中分别投入①2 mol NH3,②3 mol H2和1mol N2,达到平衡时,NH3的体积分数相同 |
您最近一年使用:0次
【推荐1】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)  CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
下列说法正确的是( )
 CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
下列说法正确的是( )
| A.T1<T2 | B.乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol |
| C.混合气体的密度始终保持不变 | D.K2=1.35 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】根据下列操作及现象,所得结论不正确的是



| 序号 | 操作及现象 | 结论 |
| A | 将 的氨水稀释10倍,测得pH由11变成 的氨水稀释10倍,测得pH由11变成 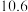 | 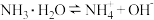 的电离程度增大 的电离程度增大 |
| B | “ 球”浸泡在热水中,颜色加深 球”浸泡在热水中,颜色加深 | 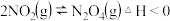 |
| C | 向25mL冷水和沸水中分别滴入5滴 饱和溶液,前者为黄色,后者为红褐色 饱和溶液,前者为黄色,后者为红褐色 | 温度升高, 的水解程度增大 的水解程度增大 |
| D | 将固体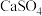 加入 加入 饱和溶液中,一段时间后,检验固体成分为 饱和溶液中,一段时间后,检验固体成分为 | 同温下溶解度: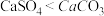 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐1】下列说法正确的是
A.一定条件下,在体积为10 L的密闭容器中充入1 mol X和1 mol Y进行反应:2X(g)+Y(g)⇌Z(g)达到平衡,若将容器体积变为20 L,则Z的平衡浓度等于原来的  |
| B.C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡 |
| C.若压强不再随时间变化时能说明反应2A(?)+B(g)⇌2C(?)已达平衡,则A、C不能同时是气体 |
| D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】2molSO2和1molO2在一定条件反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0。若恒温恒容条件下SO2的转化率为a%;恒温恒压条件下SO2的转化率为b%;恒容绝热条件下SO2的转化率为c%;则它们之间的关系是
| A.a% > b%> c% | B.b%> a% >c% | C.a% >c% > b% | D.b%> c% >a% |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】下列各表述与示意图一致的是


| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时  将增大 将增大 |
您最近一年使用:0次

 CO2(g)+H2(g)(正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可以采用的是
CO2(g)+H2(g)(正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可以采用的是

