环戊二烯(C5H6)是一种重要的有机合成原料,常用于有机合成及树脂交联等。
Ⅰ.用其制备环戊烯:
方法一:___________ kJ·mol-1。
①平衡时HI的体积分数为___________ %。
②用平衡分压代替平衡浓度计算压强平衡常数KP=___________ (KPa)-1(要求用最简整数比,含P0的代数式表示)。
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡___________ 移动(填“正向”“逆向”或“不”)。___________ T2(填“>"“<”或“=”)。
(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是___________ 。
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.
d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁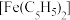 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为___________ 。二茂铁的晶胞结构如图所示(未画出微粒),密度为ρg/cm-3,设阿伏加德罗常数的值为NA,则一个晶胞中含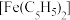 的数目为
的数目为___________ 。
Ⅰ.用其制备环戊烯:
方法一:
反应①: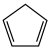 (g)+H2(g)
(g)+H2(g)
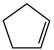 (g) ΔH1=-100.3 kJ·mol-1
(g) ΔH1=-100.3 kJ·mol-1
反应②: (g)+H2(g)
(g)+H2(g)
 (g) ΔH2=-109.4 kJ·mol-1
(g) ΔH2=-109.4 kJ·mol-1
反应③: (g)+
(g)+ (g)
(g) 2
2 (g) ΔH3
(g) ΔH3
方法二: (g)+2HI
(g)+2HI
 (g)+I2(g) ΔH4=-89.3 kJ·mol-1
(g)+I2(g) ΔH4=-89.3 kJ·mol-1
①平衡时HI的体积分数为
②用平衡分压代替平衡浓度计算压强平衡常数KP=
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡
Ⅱ.环戊二烯(C5H6)容易二聚生成双环戊二烯(C10H12):2 (g)
(g)
 (g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。
(g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。

(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.

d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁
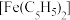 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为 的数目为
的数目为
更新时间:2024-05-09 18:59:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_____________ 。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是_______ (填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________ (反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为__________ (保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________ 。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______ v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
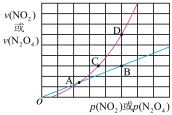
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=_______ ;在上图标出点中,指出能表示反应未达到平衡状态的点是_________ 。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)
 2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
 2NO2(g)反应速率的是
2NO2(g)反应速率的是(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示: 浓度/mol L-1 L-1时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
10 | 0.040 | 0.030 | 0.030 |
20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g)
 N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:
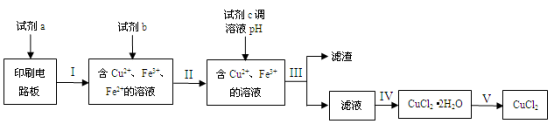
已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤III的操作名称是_______ 。
②下列试剂中,可以作为试剂a的是_______ 。
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?_______ (填“是”或“否”),理由是______ 。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H =_______ 。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是_______ 。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是_______ L。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
请回答下列问题:
①步骤III的操作名称是
②下列试剂中,可以作为试剂a的是
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H =
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____ kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。

①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____ ,产生该结论的原因是_____ 。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____ ,其压强平衡常数为_____ ;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____ 。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
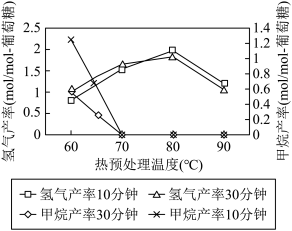
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____ 。
 CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。

①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】达成“双碳”目标的重要途径是实现碳的固定。利用CO、 和
和 可以合成生物质能源甲醇:
可以合成生物质能源甲醇:
反应1:
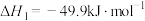
反应2:

反应3:
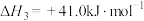
回答下列问题:
(1)反应1在___________ (填“较高温度”“较低温度”或“任何温度”)下能自发进行。
(2)
___________  。
。
(3)T℃时,向一恒容密闭容器中仅充入1molCO(g)和 ,仅发生反应2。下列叙述错误的是___________(填标号)。
,仅发生反应2。下列叙述错误的是___________(填标号)。
(4)在某催化剂作用下,反应2的历程如图所示(图中数据表示微粒的相对能量,*表示吸附在催化剂表面上)。___________ 。
(5)在某催化剂作用下,只发生反应: 。该反应的速率方程式为
。该反应的速率方程式为 ,
,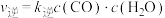 (k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
(k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
________ (填“>”“<”或“=”,下同) ,900℃时
,900℃时
________  。
。
(6) 时,在密闭容器甲、乙中,分别充入
时,在密闭容器甲、乙中,分别充入 和
和 ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。___________ (填“甲”或“乙”)。
②平衡常数
___________ (填“>”“<”或“=”)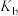 ,M点
,M点
___________ kPa。
(7)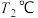 时,向一体积为1L的恒容密闭容器中充入1molCO、
时,向一体积为1L的恒容密闭容器中充入1molCO、 和
和 ,在一定条件下发生上述3个反应,达到平衡时得到
,在一定条件下发生上述3个反应,达到平衡时得到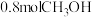 和
和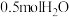 ,此时
,此时 平衡转化率为50%。该温度下,反应1的平衡常数K=
平衡转化率为50%。该温度下,反应1的平衡常数K=___________  。(列出计算式)
。(列出计算式)
 和
和 可以合成生物质能源甲醇:
可以合成生物质能源甲醇:反应1:

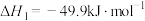
反应2:


反应3:

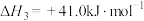
回答下列问题:
(1)反应1在
(2)

 。
。(3)T℃时,向一恒容密闭容器中仅充入1molCO(g)和
 ,仅发生反应2。下列叙述错误的是___________(填标号)。
,仅发生反应2。下列叙述错误的是___________(填标号)。| A.加入催化剂,反应速率增大 |
| B.CO体积分数不变时,反应达到平衡状态 |
| C.平衡后,充入氩气,平衡正向移动 |
D.平衡后,充入 ,CO平衡转化率增大 ,CO平衡转化率增大 |
(4)在某催化剂作用下,反应2的历程如图所示(图中数据表示微粒的相对能量,*表示吸附在催化剂表面上)。
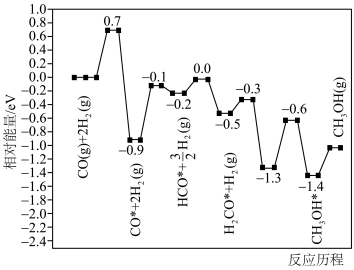
(5)在某催化剂作用下,只发生反应:
 。该反应的速率方程式为
。该反应的速率方程式为 ,
,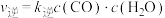 (k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
(k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后,
 ,900℃时
,900℃时
 。
。(6)
 时,在密闭容器甲、乙中,分别充入
时,在密闭容器甲、乙中,分别充入 和
和 ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。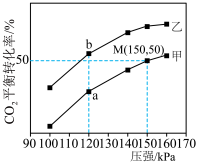
②平衡常数

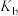 ,M点
,M点
(7)
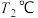 时,向一体积为1L的恒容密闭容器中充入1molCO、
时,向一体积为1L的恒容密闭容器中充入1molCO、 和
和 ,在一定条件下发生上述3个反应,达到平衡时得到
,在一定条件下发生上述3个反应,达到平衡时得到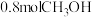 和
和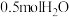 ,此时
,此时 平衡转化率为50%。该温度下,反应1的平衡常数K=
平衡转化率为50%。该温度下,反应1的平衡常数K= 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) ⇌2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) ⇌ CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
(2)“反应1”的化学反应速率v=k[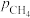 ]m·[
]m·[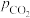 ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持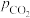 或
或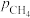 不变,测得速率v与
不变,测得速率v与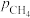 、
、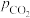 的关系如图所示:
的关系如图所示:
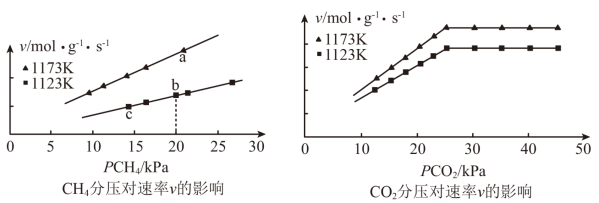
①由图可知,下列叙述正确的是_________ (填标号)。
A.当10kPa≤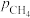 ≤25kPa时,m=l
≤25kPa时,m=l
B.其他条件不变,增大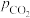 ,速率v不一定增大
,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________ mol·g-1·s-1。
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。
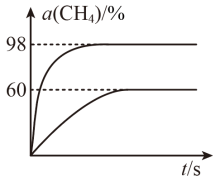
923K时,CH4(g)的平衡转化率α=_________ ,若平衡时体系的总压强为p0,平衡常数K923K=____ (用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)⇌CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:
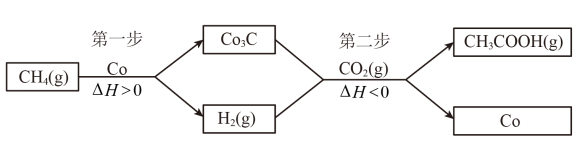
①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________ 进行;从H2浓度的角度考虑,应采取的措施是_________ 。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) ⇌2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) ⇌ CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=
(2)“反应1”的化学反应速率v=k[
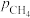 ]m·[
]m·[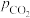 ]n,k为速率常数。1123K和1173K时,分别保持
]n,k为速率常数。1123K和1173K时,分别保持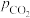 或
或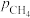 不变,测得速率v与
不变,测得速率v与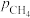 、
、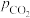 的关系如图所示:
的关系如图所示:
①由图可知,下列叙述正确的是
A.当10kPa≤
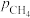 ≤25kPa时,m=l
≤25kPa时,m=lB.其他条件不变,增大
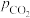 ,速率v不一定增大
,速率v不一定增大C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。

923K时,CH4(g)的平衡转化率α=
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)⇌CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:

①第二步反应的化学方程式为
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
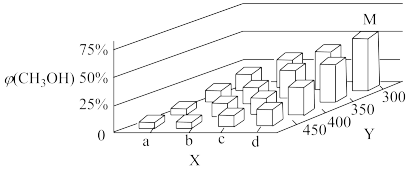
【推荐3】工业废气中CO分离后可以再利用,一定条件下用CO和H2合成CH3OH的反应为:CO(g)+2H2(g) CH3OH(g) △H<0。在2L恒容密闭容器中充入1 mol CO和2molH2,在催化剂作用下充分反应。当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) △H<0。在2L恒容密闭容器中充入1 mol CO和2molH2,在催化剂作用下充分反应。当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
回答下列问题:
(1)X轴上a点的数值比b点____________ (填“大”或“小”)。图中Y轴表示___________________ ,理由是____________________________________________________________________ 。
(2)温度为300 °C时,该反应的化学平衡常数K=________________ 。向平衡混合物中再加入0.1 mol CO和0.1 mol CH3OH(g),平衡__________________ (选填“正反应方向”、“逆反应方向”或“不”)移动。
(3)此反应使用铁镁催化剂的实际工业流程中,测得的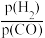 与CO的平衡转化率的关系如图1,一般采用400 °C左右、
与CO的平衡转化率的关系如图1,一般采用400 °C左右、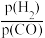 、=3~5,采用此条件的原因可能是
、=3~5,采用此条件的原因可能是_________________________________________
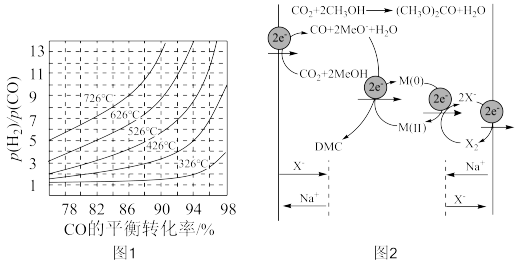
(4)二氧化碳和甲醇电解制备碳酸二甲酯反应中,会生成一氧化碳和甲醇阴离子中间体,原理如图2,此反应过程在_________________ 极发生。新研制的M(0)加入后能改变反应速率,其作用是__________________________________________________________________________ 。
 CH3OH(g) △H<0。在2L恒容密闭容器中充入1 mol CO和2molH2,在催化剂作用下充分反应。当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) △H<0。在2L恒容密闭容器中充入1 mol CO和2molH2,在催化剂作用下充分反应。当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
回答下列问题:
(1)X轴上a点的数值比b点
(2)温度为300 °C时,该反应的化学平衡常数K=
(3)此反应使用铁镁催化剂的实际工业流程中,测得的
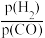 与CO的平衡转化率的关系如图1,一般采用400 °C左右、
与CO的平衡转化率的关系如图1,一般采用400 °C左右、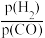 、=3~5,采用此条件的原因可能是
、=3~5,采用此条件的原因可能是
(4)二氧化碳和甲醇电解制备碳酸二甲酯反应中,会生成一氧化碳和甲醇阴离子中间体,原理如图2,此反应过程在
您最近一年使用:0次
【推荐1】乙苯催化脱氢制苯乙烯反应: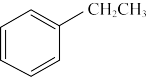 (g)
(g)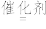
 (g)+H2(g)(可逆反应)。
(g)+H2(g)(可逆反应)。
(1)已知:
计算上述反应的ΔH=________ kJ·mol-1。
(2)维持体系总压p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kc=________ 或Kp=______ (用α等符号表示,Kc为用浓度表示的平衡常数,Kp为压强平衡常数)。
(3)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有________ (填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用
(4)综合利用CO2、CO对构建低碳社会有重要意义。
① Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为_________ 。
②工业电解生成的合成气CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将________ (选填“正向”“不”或“逆向”)移动。
 (g)
(g)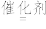
 (g)+H2(g)(可逆反应)。
(g)+H2(g)(可逆反应)。(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=
(2)维持体系总压p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kc=
(3)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用
(4)综合利用CO2、CO对构建低碳社会有重要意义。
① Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为
②工业电解生成的合成气CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g)
 CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】环氧乙烷( ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
(一)乙烯直接氧化法:
反应Ⅰ: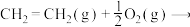
 (g)
(g) 
反应Ⅱ: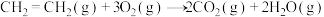

(1)乙烯与 在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。
在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为_______ 。
②M点后曲线下降的原因为_______ 。
③下列说法正确的有_______ (填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.催化剂的催化活性与温度成正比
C.不同催化剂达到最高活性时的温度不同
(2)设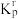 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以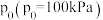 。反应Ⅰ、Ⅱ对应的
。反应Ⅰ、Ⅱ对应的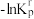 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。

①
_______ 0(填“>”或“<”)。
②在T℃的恒温、恒容密闭容器中,按体积分数充入反应混合气体:乙烯30%、氧气7%,其余混合气63%(致稳气),发生反应Ⅰ(忽略反应Ⅱ)。平衡时体系压强为2000kPa,乙烯的转化率为 ,则T℃下反应Ⅰ的相对压力平衡常数
,则T℃下反应Ⅰ的相对压力平衡常数
_______ 。
(二)电化学合成法
(3)科学家利用 、水合成环氧乙烷,有利于实现碳中和。总反应为:
、水合成环氧乙烷,有利于实现碳中和。总反应为: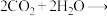

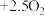 ,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
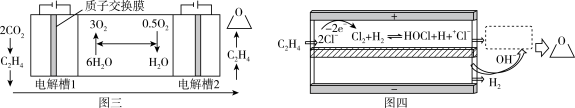
①电解槽1中阴极的电极反应式为_______ 。
②图四虚线框中发生的反应为: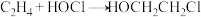 、
、_______ 、 。
。
 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:(一)乙烯直接氧化法:
反应Ⅰ:
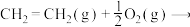
 (g)
(g) 
反应Ⅱ:
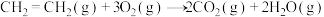

(1)乙烯与
 在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。
在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。
①依据图给信息,选择制备环氧乙烷的适宜条件为
②M点后曲线下降的原因为
③下列说法正确的有
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.催化剂的催化活性与温度成正比
C.不同催化剂达到最高活性时的温度不同
(2)设
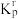 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以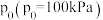 。反应Ⅰ、Ⅱ对应的
。反应Ⅰ、Ⅱ对应的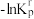 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
①

②在T℃的恒温、恒容密闭容器中,按体积分数充入反应混合气体:乙烯30%、氧气7%,其余混合气63%(致稳气),发生反应Ⅰ(忽略反应Ⅱ)。平衡时体系压强为2000kPa,乙烯的转化率为
 ,则T℃下反应Ⅰ的相对压力平衡常数
,则T℃下反应Ⅰ的相对压力平衡常数
(二)电化学合成法
(3)科学家利用
 、水合成环氧乙烷,有利于实现碳中和。总反应为:
、水合成环氧乙烷,有利于实现碳中和。总反应为: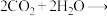

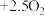 ,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
①电解槽1中阴极的电极反应式为
②图四虚线框中发生的反应为:
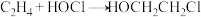 、
、 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。利用乙烷裂解制乙烯的反应为C2H6(g) C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。
(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数( )的关系如图2所示。
)的关系如图2所示。_____ (填“反应a”或“反应b”),乙烷裂解制乙烯的△H=_____ 。
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是_____ 。
(2)在恒温恒容条件下,下列情况表明反应C2H6(g) C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:_____ (填曲线标号)。
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)_____ (填“>”、“=”或“<”)v(Z)。
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为_____ kPa/min,该反应的平衡常数Kp=_____ kPa(Kp为用分压表示的平衡常数,分压=总压×体积分数)。
 C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数(
 )的关系如图2所示。
)的关系如图2所示。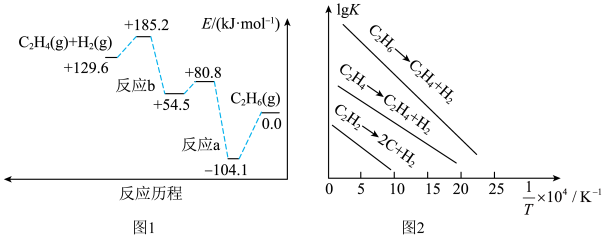
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是
(2)在恒温恒容条件下,下列情况表明反应C2H6(g)
 C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。| A.混合气体密度保持不变 | B.气体总压强保持不变 |
| C.气体平均摩尔质量保持不变 | D.产物浓度之比保持不变 |
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:
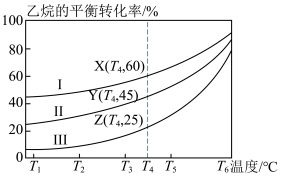
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为
您最近一年使用:0次



