名校
1 . 合成氨对人类生存具有重大意义,反应为:
 。
。
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
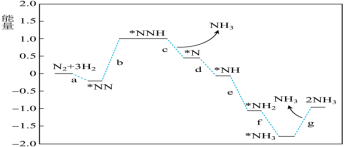
由图像可知合成氨反应的
___________ 0(填“>”“<”或“=”),判断的依据是___________ 。
(2)下列有关合成氨的说法中,正确的是___________。
(3)原料气( 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有___________________ (写出两点)。
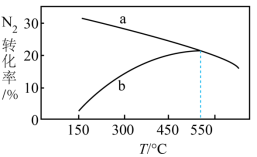
(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是___________ (填“a”或“b”),随着温度的升高,乙容器中 的转化率变化的原因可能是
的转化率变化的原因可能是___________ 。
(5)一定条件下,若向容积为1.0L的反应容器中投入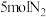 、
、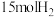 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
___________ (可用分数表示)。

 。
。(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。

由图像可知合成氨反应的

(2)下列有关合成氨的说法中,正确的是___________。
| A.反应物断键吸收的总能量高于生成物成键放出的总能量 |
| B.使用催化剂和施加高压,都能提高反应速率,但都对化学平衡状态无影响 |
| C.合成氨工业温度选择400~500℃,主要是为了提高平衡混合物中氨的含量 |
| D.合成氨生产过程中采用循环操作,主要是为了提高氮气和氢气的利用率 |
 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的
 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是 的转化率变化的原因可能是
的转化率变化的原因可能是
(5)一定条件下,若向容积为1.0L的反应容器中投入
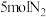 、
、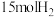 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
您最近一年使用:0次
名校
2 . H2O2 是一种绿色氧化还原试剂,在化学研究中应用广泛。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是_______ (要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
①通过实验Ⅱ、Ⅲ探究的是_______ 对反应速率影响。
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是_______ 。
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因_______ 。
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为_______ 。
(4)判断滴定终点的方法是_______ 。
(5)产品中N2O4的质量分数为_______ 。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
| 序号 | H2O2/mL | 蒸馏水/mL | FeCl3溶液/mL | 现象 |
| Ⅰ | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红褐色,并有较多气泡产生;2 min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变红褐色,开始5 s后产生较少的气泡 |
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为
(4)判断滴定终点的方法是
(5)产品中N2O4的质量分数为
您最近一年使用:0次
12-13高二上·江西宜春·阶段练习
名校
解题方法
3 . 在一容积可变的密闭容器中加入一定量的X、Y,发生反应mX(g)⇌nY(g) ∆H=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确 的是
| 温度(℃) | c(Y)/(mol/L) | ||
| 1L | 2L | 4L | |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
| A.m>n |
| B.Q<0 |
| C.体积不变,温度升高,平衡向逆反应方向移动 |
| D.温度不变,压强增大,Y的质量分数减少 |
您最近一年使用:0次
2024-01-18更新
|
35次组卷
|
22卷引用:2015届黑龙江省双鸭山市第一中学高三9月月考化学试卷
(已下线)2015届黑龙江省双鸭山市第一中学高三9月月考化学试卷(已下线)2011-2012学年江西省上高二中高二上学期第三次月考化学试卷(已下线)2012-2013学年河北省邢台一中高一下学期第三次月考化学试卷(已下线)2013-2014学年黑龙江省哈师大附中高二上学期期中化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷黑龙江省孙吴县第一中学2017-2018学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题湖南省常德市第一中学2023-2024学年高二上学期12月月考化学试题(已下线)2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷(已下线)2013-2014学年安徽省屯溪一中高二上学期期中考试化学试卷(已下线)2014年高二化学人教版选修四 8化学平衡移动练习卷(已下线)2014-2015湖南省新化一中高二上学期期中化学试卷2014-2015学年内蒙古包头市第一中学高一下学期期末考试化学试卷2015-2016浙江宁波效实中学高二上期中考试化学试题卷2015-2016学年云南省昆明三中高二下期中化学试卷辽宁省大连市第二十四中学2017-2018学年高二上学期期中考试化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡吉林省白城市第一中学2018-2019学年高一下学期期末考试化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题吉林省延边朝鲜族自治州汪清县第四中学2020-2021学年高二上学期期末考试化学试题湖南师范大学附属中学2021-2022学年高一下学期期末考试化学试题海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷
名校
解题方法
4 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近一年使用:0次
2023-11-14更新
|
375次组卷
|
25卷引用:黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题
黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
5 . 在一密闭容器中,反应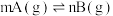 达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的
达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的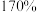 ,则正确的是
,则正确的是
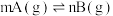 达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的
达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的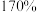 ,则正确的是
,则正确的是A. | B.物质A的转化率增大了 |
| C.物质A的质量分数减小了 | D.平衡向逆反应方向移动了 |
您最近一年使用:0次
名校
6 . 大气中二氧化碳 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
相关主要反应有:
①
②

③

④

⑤

回答下列问题:
(1)通过 与
与 和
和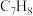 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
___________ 。
(2)下图显示了在 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是___________ 。

(3)其他条件不变, 时(如右图),
时(如右图), 和
和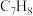 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是___________ 。在 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为___________ (已知:二甲苯的选择性 ,产率=转化率×选择性)。
,产率=转化率×选择性)。
(4)该工艺采用 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使___________ ,致使反应速率下降。
(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表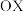 :
: 。则反应
。则反应 的
的
___________ 0,(填“>”或“<”)判断依据是___________ 。

 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。相关主要反应有:
①

②


③


④


⑤


回答下列问题:
(1)通过
 与
与 和
和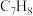 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
(2)下图显示了在
 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是
(3)其他条件不变,
 时(如右图),
时(如右图), 和
和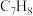 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为 ,产率=转化率×选择性)。
,产率=转化率×选择性)。(4)该工艺采用
 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯
 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表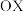 :
: 。则反应
。则反应 的
的

您最近一年使用:0次
名校
7 . 合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1.。一种工业合成氨的简式流程如图1所示:
2NH3(g) ΔH=-92.4kJ·mol-1.。一种工业合成氨的简式流程如图1所示:

步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
(1)对于反应①,一定可以提高平衡体系中H2的百分含量,且能加快反应速率的措施是___________。
(2)图2表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数:___________ 。

(3)合成氨反应中正反应速率v正=k正c(N2)•c3(H2),逆反应速率v逆=k逆c2(NH3),k正、k逆为速率常数。平衡常数K与温度的关系如图。

①表示正反应的平衡常数K与温度变化的曲线为___________ (填L1或L2)。
②平衡时,合成氨反应的平衡常数K=___________ (用k正、k逆表示)。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)___________ 。简述本流程中提高合成氨原料总转化率的方法:___________ (写出2条即可)。
(5)合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是[Cu(NH3)2CH3COO]+CO+NH3 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)。必须除去原料气中CO的原因是
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)。必须除去原料气中CO的原因是___________ 。
(6)相同温度下,有体积相同的甲、乙两个恒容密闭容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述中正确的是___________
 2NH3(g) ΔH=-92.4kJ·mol-1.。一种工业合成氨的简式流程如图1所示:
2NH3(g) ΔH=-92.4kJ·mol-1.。一种工业合成氨的简式流程如图1所示:
步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1(1)对于反应①,一定可以提高平衡体系中H2的百分含量,且能加快反应速率的措施是___________。
| A.降低压强 | B.增大水蒸气浓度 | C.加入催化剂 | D.升高温度 |

(3)合成氨反应中正反应速率v正=k正c(N2)•c3(H2),逆反应速率v逆=k逆c2(NH3),k正、k逆为速率常数。平衡常数K与温度的关系如图。

①表示正反应的平衡常数K与温度变化的曲线为
②平衡时,合成氨反应的平衡常数K=
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)
(5)合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是[Cu(NH3)2CH3COO]+CO+NH3
 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)。必须除去原料气中CO的原因是
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)。必须除去原料气中CO的原因是(6)相同温度下,有体积相同的甲、乙两个恒容密闭容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述中正确的是___________
| A.化学反应速率:乙>甲 | B.平衡后N2的浓度:乙>甲 |
| C.H2的平衡转化率:甲>乙 | D.平衡后混合气体中H2的体积分数:乙>甲 |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要的作用。
(1)下图是 和
和 反应生成
反应生成 过程中能量的变化示意图,请写出
过程中能量的变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:_____ 。

(2)若已知下列数据:
试根据表中及图中数据计算 的键能:
的键能:_____  。
。
Ⅱ、我国力争于2030年前做到碳达峰,2060年前实现碳中和。 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系主要涉及以下反应:
利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)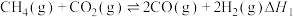
b)
c)
d)
e)
(3)根据盖斯定律,反应 的
的
_____ (写出一个代数式即可)。
(4)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
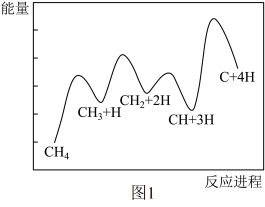
(5)一定条件下, 分解形成碳的反应历程如图1所示。该历程分
分解形成碳的反应历程如图1所示。该历程分_____ 步进行,其中,第_____ 步的正反应活化能最大。
(6)设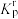 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。反应a、c、e的
。反应a、c、e的 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
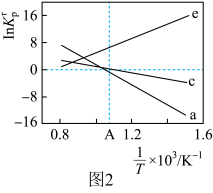
①反应a、c、e中,属于吸热反应的有_____ (填字母)。
②反应c的相对压力平衡常数表达式为
_____ 。
③在图2中 点对应温度下、原料组成为
点对应温度下、原料组成为 、初始总压为
、初始总压为 的恒容密闭容器中进行反应,体系达到平衡时
的恒容密闭容器中进行反应,体系达到平衡时 的分压为
的分压为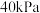 。计算
。计算 的平衡转化率等于
的平衡转化率等于_____
(7) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:_____ 。
(1)下图是
 和
和 反应生成
反应生成 过程中能量的变化示意图,请写出
过程中能量的变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:
(2)若已知下列数据:
| 化学键 |  |  |
键能 | 435 | 943 |
 的键能:
的键能: 。
。Ⅱ、我国力争于2030年前做到碳达峰,2060年前实现碳中和。
 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系主要涉及以下反应:
利用的研究热点之一。该重整反应体系主要涉及以下反应:a)
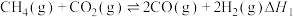
b)

c)

d)

e)

(3)根据盖斯定律,反应
 的
的
(4)上述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.增大 与 与 的浓度,反应 的浓度,反应 的正反应速率都增加 的正反应速率都增加 |
B.移去部分 ,反应 ,反应 的平衡均向右移动 的平衡均向右移动 |
C.加入反应 的催化剂,可提高 的催化剂,可提高 的平衡转化率 的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
(5)一定条件下,
 分解形成碳的反应历程如图1所示。该历程分
分解形成碳的反应历程如图1所示。该历程分
(6)设
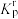 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。反应a、c、e的
。反应a、c、e的 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为

③在图2中
 点对应温度下、原料组成为
点对应温度下、原料组成为 、初始总压为
、初始总压为 的恒容密闭容器中进行反应,体系达到平衡时
的恒容密闭容器中进行反应,体系达到平衡时 的分压为
的分压为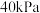 。计算
。计算 的平衡转化率等于
的平衡转化率等于(7)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
9 . 向体积为 的固定密闭容器中通入
的固定密闭容器中通入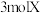 气体,在一定温度下发生如下反应:
气体,在一定温度下发生如下反应: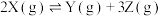
(1)经 后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为
后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为_____ 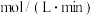 。
。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲: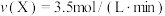 ;乙:
;乙: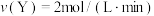 ;丙:
;丙: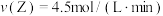 ;丁:
;丁: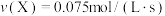 。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)
。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)_____ 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向_____ (填“左”“右”或“不”,下同)移动。
(4)若在相同条件下向达到(1)所述平衡体系中再充入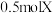 气体,则平衡后X的转化率与(1)的平衡中X的转化率相比_____。
气体,则平衡后X的转化率与(1)的平衡中X的转化率相比_____。
(5)若保持与(1)的温度和压强不变,起始时加入X、Y、Z物质的量分别为 、
、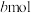 、
、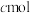 ,达平衡时各物质百分含量与(1)平衡时相等,则
,达平衡时各物质百分含量与(1)平衡时相等,则 应满足的关系为
应满足的关系为_____ 。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为 、
、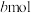 、
、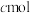 ,达平衡时各物质浓度与(1)平衡时相等,则起始时维持化学反应向逆反应方向进行,则
,达平衡时各物质浓度与(1)平衡时相等,则起始时维持化学反应向逆反应方向进行,则 的取值范围应为
的取值范围应为_____ 。
 的固定密闭容器中通入
的固定密闭容器中通入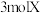 气体,在一定温度下发生如下反应:
气体,在一定温度下发生如下反应: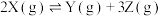
(1)经
 后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为
后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为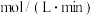 。
。(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:
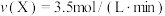 ;乙:
;乙: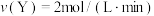 ;丙:
;丙: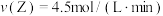 ;丁:
;丁: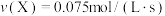 。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)
。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)(3)若向达到(1)的平衡体系中充入氩气,则平衡向
(4)若在相同条件下向达到(1)所述平衡体系中再充入
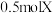 气体,则平衡后X的转化率与(1)的平衡中X的转化率相比_____。
气体,则平衡后X的转化率与(1)的平衡中X的转化率相比_____。| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
 、
、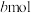 、
、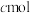 ,达平衡时各物质百分含量与(1)平衡时相等,则
,达平衡时各物质百分含量与(1)平衡时相等,则 应满足的关系为
应满足的关系为(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为
 、
、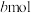 、
、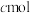 ,达平衡时各物质浓度与(1)平衡时相等,则起始时维持化学反应向逆反应方向进行,则
,达平衡时各物质浓度与(1)平衡时相等,则起始时维持化学反应向逆反应方向进行,则 的取值范围应为
的取值范围应为
您最近一年使用:0次
名校
解题方法
10 . 现有一定条件下某反应mA(g) +nB(g)  pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。

回答下列问题:
(1)该反应是___________ 热反应,且m+n___________ (填“>” “<”或“=”)p。
(2)降温时,混合体系中C的质量分数___________ (填“增大”“减小”或“不变”,下同)。
(3)若增加A的用量(A、B的总体积不变),则B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比 将
将___________ 。
 pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。
pC(g) ,其不同温度下的化学平衡常数(K)如下表所示(K1<K2<K3),图象表示反应达平衡后,t2时刻增大压强时速率(v)随时间(t)的变化情况。| 温度/℃ | 250 | 300 | 350 |
| K | K1 | K2 | K3 |

回答下列问题:
(1)该反应是
(2)降温时,混合体系中C的质量分数
(3)若增加A的用量(A、B的总体积不变),则B的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
 将
将
您最近一年使用:0次
2021-11-18更新
|
543次组卷
|
3卷引用:黑龙江省虎林市高级中学2022-2023学年高二9月月考化学试题



