名校
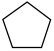
1 . 环戊二烯(C5H6)是一种重要的有机合成原料,常用于有机合成及树脂交联等。
Ⅰ.用其制备环戊烯:
方法一:___________ kJ·mol-1。
①平衡时HI的体积分数为___________ %。
②用平衡分压代替平衡浓度计算压强平衡常数KP=___________ (KPa)-1(要求用最简整数比,含P0的代数式表示)。
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡___________ 移动(填“正向”“逆向”或“不”)。___________ T2(填“>"“<”或“=”)。
(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是___________ 。
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.
d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁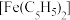 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为___________ 。二茂铁的晶胞结构如图所示(未画出微粒),密度为ρg/cm-3,设阿伏加德罗常数的值为NA,则一个晶胞中含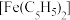 的数目为
的数目为___________ 。
Ⅰ.用其制备环戊烯:
方法一:
反应①: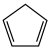 (g)+H2(g)
(g)+H2(g)
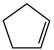 (g) ΔH1=-100.3 kJ·mol-1
(g) ΔH1=-100.3 kJ·mol-1
反应②: (g)+H2(g)
(g)+H2(g)
 (g) ΔH2=-109.4 kJ·mol-1
(g) ΔH2=-109.4 kJ·mol-1
反应③: (g)+
(g)+ (g)
(g) 2
2 (g) ΔH3
(g) ΔH3
方法二: (g)+2HI
(g)+2HI
 (g)+I2(g) ΔH4=-89.3 kJ·mol-1
(g)+I2(g) ΔH4=-89.3 kJ·mol-1
①平衡时HI的体积分数为
②用平衡分压代替平衡浓度计算压强平衡常数KP=
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡
Ⅱ.环戊二烯(C5H6)容易二聚生成双环戊二烯(C10H12):2 (g)
(g)
 (g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。
(g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。

(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.

d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁
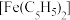 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为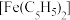 的数目为
的数目为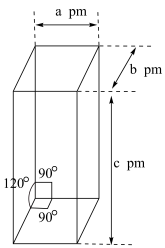
您最近一年使用:0次
2 . 用乙烷为原料制备乙烯,可以降低制备成本。
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g) C2H4(g)+H2(g) ΔH。
C2H4(g)+H2(g) ΔH。
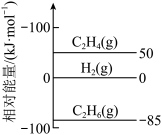
①已知:298K时,相关物质的相对能量如图:___________ 。
②___________ (填高温或低温)有利于此反应自发进行。
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g)
C2H4(g)+H2O(g)
①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g) 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是___________ 。②探究该反应的适宜条件,得到下图数据:
乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中 的变化情况。
的变化情况。
用该方法制备乙烯应该选择的适宜条件为:温度___________ ℃; =
=___________ 。
(3)温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H<0 K=2。
HCOOH(g) △H<0 K=2。
①实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=___________ k逆。
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强___________ (填“大于”“小于”或“等于”)T1℃时平衡压强,判断依据是___________ 。
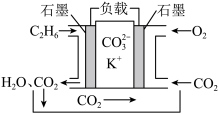
(4)某乙烷熔融燃料电池工作原理如下图所示:___________ 。
(1)传统制备方法:乙烷催化裂解法发生的反应为:C2H6(g)
 C2H4(g)+H2(g) ΔH。
C2H4(g)+H2(g) ΔH。①已知:298K时,相关物质的相对能量如图:
②
(2)乙烷氧化裂解制乙烯[主反应为C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g)
C2H4(g)+H2O(g)①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g)
 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是
乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中
 的变化情况。
的变化情况。用该方法制备乙烯应该选择的适宜条件为:温度
 =
=(3)温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H<0 K=2。
HCOOH(g) △H<0 K=2。①实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=
②温度为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(4)某乙烷熔融燃料电池工作原理如下图所示:
您最近一年使用:0次
3 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=-746.5kJ/mol。
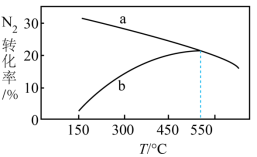
(1)某研究小组在三个容积为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:(填"<"、">""或"=",)

①温度:T1_______ T2.
②CO的平衡转化率:I_______ Ⅱ_______ Ⅲ
③反应速率:a点的v逆_______ b点的v正
④T2时的平衡常数K=_______ 。
(2)将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即NO的转化率)如图所示。M点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,说明理由_______ 。

(1)某研究小组在三个容积为5L的恒容密闭容器中,分别充入0.4molNO和0.4molCO。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:(填"<"、">""或"=",)

①温度:T1
②CO的平衡转化率:I
③反应速率:a点的v逆
④T2时的平衡常数K=
(2)将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即NO的转化率)如图所示。M点

您最近一年使用:0次
名校
4 . 大气中二氧化碳 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
相关主要反应有:
①
②

③

④

⑤

回答下列问题:
(1)通过 与
与 和
和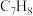 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
___________ 。
(2)下图显示了在 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是___________ 。

(3)其他条件不变, 时(如右图),
时(如右图), 和
和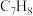 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是___________ 。在 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为___________ (已知:二甲苯的选择性 ,产率=转化率×选择性)。
,产率=转化率×选择性)。
(4)该工艺采用 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使___________ ,致使反应速率下降。
(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表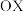 :
: 。则反应
。则反应 的
的
___________ 0,(填“>”或“<”)判断依据是___________ 。

 导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将
导致全球变暖和海洋酸化等问题愈发严重。基于功能催化剂将 氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。
氢化和甲苯甲基化过程耦合直接合成二甲苯(X)等高价值化学品的过程也展现出巨大潜力。相关主要反应有:
①

②


③


④


⑤


回答下列问题:
(1)通过
 与
与 和
和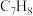 直接甲基化得二甲苯(
直接甲基化得二甲苯( )的
)的
(2)下图显示了在
 下,进料组成为
下,进料组成为 时的平衡产物分布(如左图),
时的平衡产物分布(如左图), 后
后 的转化率升高的原因是
的转化率升高的原因是
(3)其他条件不变,
 时(如右图),
时(如右图), 和
和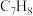 的平衡转化率随温度变化趋势与
的平衡转化率随温度变化趋势与 下不同的原因是
下不同的原因是 下,二甲苯的平衡产率为
下,二甲苯的平衡产率为 ,产率=转化率×选择性)。
,产率=转化率×选择性)。(4)该工艺采用
 为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使
为催化剂,进料混合气体需要净化预处理,目的是防止混有的杂质气体使(5)已知在不同温度下,产物二甲苯的各种组分邻二甲苯
 、间二甲苯
、间二甲苯 和对二甲苯
和对二甲苯 百分含量如图所示,
百分含量如图所示, 分别代表从
分别代表从 升温至
升温至 测定的实验数据,其中b点坐标代表
测定的实验数据,其中b点坐标代表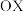 :
: 。则反应
。则反应 的
的

您最近一年使用:0次
名校
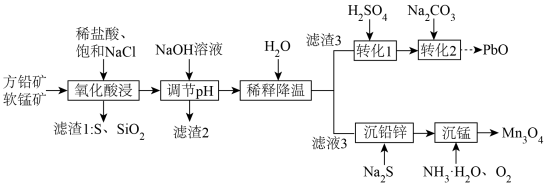
5 . 一种以方铅矿(主要成分为 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:① 。
。
②常温下,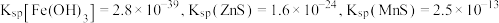 ,
, 。
。
(1) 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是___________ (填元素符号)。
(2)“氧化酸浸”时, 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为___________ 。随着温度的升高,各元素的浸出率变化如图所示,当温度高于 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是___________ 。

(3)“调节 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分___________ 。
(4)结合平衡移动原理,解释“稀释降温”的目的:___________ 。
(5)“滤液3”中的金属阳离子除了少量 外,还有
外,还有___________ 。
(6)常温下,用 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为___________  (设
(设 的平衡浓度为
的平衡浓度为 )。
)。
(7)一定条件下,写出“沉锰”制备 的化学方程式
的化学方程式___________ 。
 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:①
 。
。②常温下,
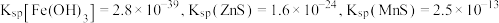 ,
, 。
。(1)
 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是(2)“氧化酸浸”时,
 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是
(3)“调节
 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分(4)结合平衡移动原理,解释“稀释降温”的目的:
(5)“滤液3”中的金属阳离子除了少量
 外,还有
外,还有(6)常温下,用
 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为 (设
(设 的平衡浓度为
的平衡浓度为 )。
)。(7)一定条件下,写出“沉锰”制备
 的化学方程式
的化学方程式
您最近一年使用:0次
名校
6 . 合成氨对人类生存具有重大意义,反应为:
 。
。
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
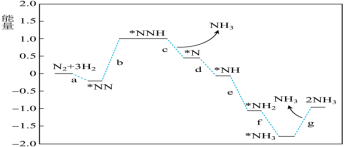
由图像可知合成氨反应的
___________ 0(填“>”“<”或“=”),判断的依据是___________ 。
(2)下列有关合成氨的说法中,正确的是___________。
(3)原料气( 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有___________________ (写出两点)。
(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是___________ (填“a”或“b”),随着温度的升高,乙容器中 的转化率变化的原因可能是
的转化率变化的原因可能是___________ 。
(5)一定条件下,若向容积为1.0L的反应容器中投入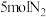 、
、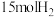 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
___________ (可用分数表示)。

 。
。(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。

由图像可知合成氨反应的

(2)下列有关合成氨的说法中,正确的是___________。
| A.反应物断键吸收的总能量高于生成物成键放出的总能量 |
| B.使用催化剂和施加高压,都能提高反应速率,但都对化学平衡状态无影响 |
| C.合成氨工业温度选择400~500℃,主要是为了提高平衡混合物中氨的含量 |
| D.合成氨生产过程中采用循环操作,主要是为了提高氮气和氢气的利用率 |
 、
、 及少量CO、
及少量CO、 的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
的混合气)中CO气体会影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:Ac代表
(注:Ac代表 )。利于CO被吸收的反应条件有
)。利于CO被吸收的反应条件有(4)若一定条件下,向体积相同的甲(含催化剂)、乙(不含催化剂)两个恒容密闭容器中分别充入等量的
 和等量的
和等量的 进行合成氨反应。反应相同时间时测得两容器中
进行合成氨反应。反应相同时间时测得两容器中 的转化率随温度的变化如图所示,表示甲容器中
的转化率随温度的变化如图所示,表示甲容器中 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是 的转化率变化的原因可能是
的转化率变化的原因可能是
(5)一定条件下,若向容积为1.0L的反应容器中投入
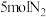 、
、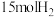 ,平衡时混合气中
,平衡时混合气中 的质量分数为40%,计算平衡常数
的质量分数为40%,计算平衡常数
您最近一年使用:0次
名校
7 . 杭州亚运会主火炬燃料是“零碳甲醇”,这是一种利用焦炉气中的H2和工业废气捕获的CO2生产的绿色燃料。两者在适宜的过渡金属及其氧化物催化下发生反应:
(1)已知:


①则K1=___________ (用含 K2和 K3的代数式表示);
②实验测得 K2(记作lnK)与温度(T)的关系如图所示,则该反应
___________ 0(填“>”“<”或“=”)。

(2)从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是___________ ;
(3)250℃,在甲(容积为4L)、乙(容积为2L)两刚性容器中分别充入2molCO2和6molH2,在适宜的催化剂作用下发生合成甲醇的反应,容器内总压强随时间变化如图所示:

①其中B曲线对应___________ 容器中压强的变化情况(填“甲”或“乙”):
②利用图中数据计算250℃该反应的分压平衡常数Kp=___________ (结果用分数表示)。
③工业上利用2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是
CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是___________ 。(填字母)
a.2v正(CO2)=v逆(CH3OCH3) b.容器内气体的密度保持不变
c.容器内温度保持不变 d.容器内比值 保持不变
保持不变
(4)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是___________ 。

②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因___________ 。
(1)已知:



①则K1=
②实验测得 K2(记作lnK)与温度(T)的关系如图所示,则该反应


(2)从焦炉气中提取氢气,需净化原料气,尤其要脱除其中的含硫杂质。除了从环保角度考虑外,其主要目的是
(3)250℃,在甲(容积为4L)、乙(容积为2L)两刚性容器中分别充入2molCO2和6molH2,在适宜的催化剂作用下发生合成甲醇的反应,容器内总压强随时间变化如图所示:

①其中B曲线对应
②利用图中数据计算250℃该反应的分压平衡常数Kp=
③工业上利用2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是
CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是a.2v正(CO2)=v逆(CH3OCH3) b.容器内气体的密度保持不变
c.容器内温度保持不变 d.容器内比值
 保持不变
保持不变(4)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是

②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因
您最近一年使用:0次
8 . Ⅰ.已知常温下几种酸的电离常数(见表格),完成下列问题:
(1)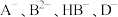 四种离子结合H+的能力最强的是
四种离子结合H+的能力最强的是___________ 。
(2)NaD溶液中加入少量H2B,反应的离子方程式为___________ 。
(3)在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中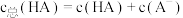 ,当达到平衡时,
,当达到平衡时,

①溶液Ⅱ中 为
为___________ 。
②溶液Ⅰ中HA的电离度[ ]
]___________ (用分数表示)。
③溶液Ⅰ和Ⅱ中的c(A-)之比约为___________ 。
Ⅱ.K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)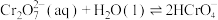
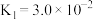 (25℃)
(25℃)
(ⅱ)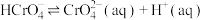
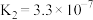 (25℃)
(25℃)
(4) 的平衡常数为
的平衡常数为___________ (用K1和K2表示)。
(5)下列有关K2Cr2O7溶液的说法正确的有___________
(6)25℃时,0.1 mol/LK2Cr2O7溶液中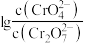 随pH的变化关系如图。当pH=9.00时,设
随pH的变化关系如图。当pH=9.00时,设 、
、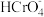 与
与 的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为
的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为___________ =0.20 mol/L;计算溶液中 的平衡浓度
的平衡浓度___________ (结果保留两位有效数字)。

| HA |  | HD |
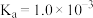 | 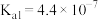 、 、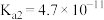 | 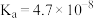 |
(1)
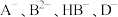 四种离子结合H+的能力最强的是
四种离子结合H+的能力最强的是(2)NaD溶液中加入少量H2B,反应的离子方程式为
(3)在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中
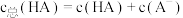 ,当达到平衡时,
,当达到平衡时, 
①溶液Ⅱ中
 为
为②溶液Ⅰ中HA的电离度[
 ]
]③溶液Ⅰ和Ⅱ中的c(A-)之比约为
Ⅱ.K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)
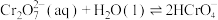
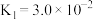 (25℃)
(25℃)(ⅱ)
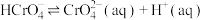
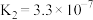 (25℃)
(25℃)(4)
 的平衡常数为
的平衡常数为(5)下列有关K2Cr2O7溶液的说法正确的有___________
| A.加入少量硫酸,溶液的黄色加深,pH不变 |
| B.加入少量水稀释,ⅰ和ⅱ均正向移动,溶液中离子总数增加 |
| C.加入少量NaOH溶液,反应(i)的平衡正向移动 |
D.加入少量K2Cr2O7固体,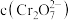 增大,平衡时 增大,平衡时 与 与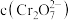 的比值变小 的比值变小 |
(6)25℃时,0.1 mol/LK2Cr2O7溶液中
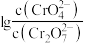 随pH的变化关系如图。当pH=9.00时,设
随pH的变化关系如图。当pH=9.00时,设 、
、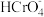 与
与 的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为
的平衡浓度分别为a、b、c mol/L,则a、b、c间的关系式为 的平衡浓度
的平衡浓度
您最近一年使用:0次
名校
9 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
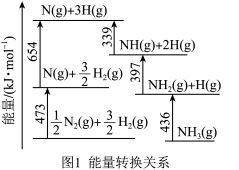
(1)根据图1数据计算反应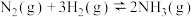 的
的
___________  。
。
(2)在Fe的催化作用下的反应历程如下(*表示吸附态):
化学吸附: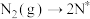 ;
;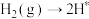 。
。
表面反应: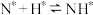 ;
;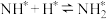 ;
;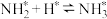
脱附: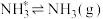 。
。
其中, 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为1:2.8.分析说明原料气中
物质的量之比为1:2.8.分析说明原料气中 过量的两个理由
过量的两个理由___________ ﹔___________ 。
(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 ,另一种为
,另一种为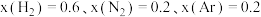 。
。

①图中压强 由大到小的顺序为
由大到小的顺序为___________ 。
②进料组成中不含有惰性气体Ar的图是___________ 。
③图3中,当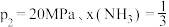 时,氮气的转化率
时,氮气的转化率
___________ 。该温度时,反应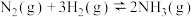 的平衡常数
的平衡常数
___________  (以
(以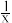 形式表示)。
形式表示)。

(1)根据图1数据计算反应
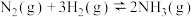 的
的
 。
。(2)在Fe的催化作用下的反应历程如下(*表示吸附态):
化学吸附:
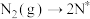 ;
;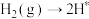 。
。表面反应:
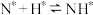 ;
;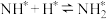 ;
;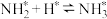
脱附:
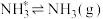 。
。其中,
 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为1:2.8.分析说明原料气中
物质的量之比为1:2.8.分析说明原料气中 过量的两个理由
过量的两个理由(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
 ,另一种为
,另一种为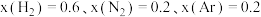 。
。
①图中压强
 由大到小的顺序为
由大到小的顺序为②进料组成中不含有惰性气体Ar的图是
③图3中,当
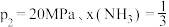 时,氮气的转化率
时,氮气的转化率
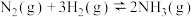 的平衡常数
的平衡常数
 (以
(以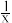 形式表示)。
形式表示)。
您最近一年使用:0次
名校
10 . H2O2 是一种绿色氧化还原试剂,在化学研究中应用广泛。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是_______ (要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
①通过实验Ⅱ、Ⅲ探究的是_______ 对反应速率影响。
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是_______ 。
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因_______ 。
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为_______ 。
(4)判断滴定终点的方法是_______ 。
(5)产品中N2O4的质量分数为_______ 。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
| 序号 | H2O2/mL | 蒸馏水/mL | FeCl3溶液/mL | 现象 |
| Ⅰ | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红褐色,并有较多气泡产生;2 min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变红褐色,开始5 s后产生较少的气泡 |
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为
(4)判断滴定终点的方法是
(5)产品中N2O4的质量分数为
您最近一年使用:0次



